Индуцированные стволовые клетки
Индуцированные стволовые клетки (iSC) - это стволовые клетки , полученные из соматических , репродуктивных, плюрипотентных или других типов клеток путем преднамеренного эпигенетического перепрограммирования. Они классифицируются как тотипотентные (iTC), плюрипотентные (iPSC) или прогениторные (мультипотентные – iMSC, также называемые индуцированными мультипотентными клетками – предшественниками – iMPC) или унипотентные (iUSC) в зависимости от их потенциала развития и степени дедифференцировки . Прародители получают путем так называемого прямого перепрограммирования или направленной дифференцировки, а также называются индуцированными соматическими стволовыми клетками .
Широко известны три метода:
- Трансплантация ядер, взятых из соматических клеток, в ооцит (яйцеклетку), лишенный собственного ядра (удалена в лаборатории)
- Слияние соматических клеток с плюрипотентными стволовыми клетками и
- Трансформация соматических клеток в стволовые клетки, используя генетический материал, кодирующий белок перепрограммирования факторов,рекомбинантные белки; микроРНК,синтетический, самовоспроизводящихся polycistronic РНК и низкомолекулярных биологически активных веществ.
Естественные процессы[править]
В 1895 году Томас Морган удалил одну из двух бластомер лягушки и обнаружил, что амфибии способны формировать целый эмбрион s из оставшейся части. Это означало, что клетки могут изменять свой путь дифференцировки. В 1924 году Шпеман и мангольд продемонстрировали ключевое значение клеточно-клеточных индукций в развитии животных.[20] обратимая трансформация клеток одного дифференцированного клеточного типа в другой называется метаплазией .] этот переход может быть частью нормального процесса созревания или вызван каким-либо побуждением.
Одним из примеров является трансформация клеток радужки в клетки хрусталика в процессе созревания и трансформация клеток пигментного эпителия сетчатки в нервную сетчатку при регенерации в глазах взрослых тритонов. Этот процесс позволяет организму заменить клетки, не соответствующие новым условиям, на более подходящие новые клетки. У Дрозофилы имагинальные диски, клетки должны выбирать из ограниченного числа стандартных дискретных состояний дифференцировки. Тот факт, что трансдетерминация (изменение пути дифференцировки) часто происходит для группы клеток, а не для отдельных клеток, показывает, что она индуцируется, а не является частью созревания.
Исследователям удалось выявить минимальные условия и факторы, которые были бы достаточны для запуска каскада молекулярных и клеточных процессов, чтобы научить плюрипотентные клетки организовывать эмбрион . Они показали , что противоположные градиенты костного морфогенетического белка (BMP) и узлового , двух членов семейства трансформирующих факторов роста, которые действуют как морфогены , достаточны для индуцирования молекулярных и клеточных механизмов, необходимых для организации, in vivo или in vitro, незафиксированных клеток полюса животного бластулы зебры в хорошо развитый эмбрион .
Некоторые типы зрелых, специализированных взрослых клеток могут естественным образом вернуться к стволовым клеткам. Например," главные " клетки экспрессируют маркер стволовой клетки Troy. Хотя они обычно производят пищеварительные жидкости для желудка, они могут вернуться в стволовые клетки, чтобы сделать временный ремонт травм желудка, таких как порез или повреждение от инфекции. Более того, они могут осуществить этот переход даже при отсутствии заметных повреждений и способны восполнять целые желудочные единицы, по сути служа спокойным "резервом" стволовых клеток. Дифференцированные эпителиальные клетки дыхательных путей могут превращаться в стабильные и функциональные стволовые клетки in vivo . После травмы зрелые терминально дифференцированные клетки почек дифференцируются в более примордиальные варианты самих себя и затем дифференцируются в типы клеток, нуждающиеся в замене в поврежденной ткани макрофаги могут самообновляться путем локальной пролиферации зрелых дифференцированных клеток. У тритонов мышечная ткань регенерируется из специализированных мышечных клеток, которые дедифференцируются и забывают тип клетки, в которой они были. Эта способность к регенерации не снижается с возрастом и может быть связана с их способностью производить новые стволовые клетки из мышечных клеток по требованию.
Различные нетуморигенные стволовые клетки проявляют способность генерировать несколько типов клеток. Например, мультилинейные дифференцирующие стресс-устойчивые (Муз) клетки являются стрессоустойчивыми стволовыми клетками взрослого человека, которые могут самообновляться. Они образуют характерные клеточные кластеры в суспензионной культуре, которые экспрессируют набор генов, связанных с плюрипотентностью , и могут дифференцироваться в эндодермальные, эктодермальные и мезодермальные клетки как in vitro, так и in vivo.
Другие хорошо документированные примеры трансдифференциации и их значение в развитии и регенерации были подробно описаны.
Индуцированные тотипотентные клетки[править]
SCNT-опосредованный[править]
Индуцированные тотипотентные клетки могут быть получены путем перепрограммирования соматических клеток с ядерным переносом соматических клеток (SCNT). Процесс включает высасывание ядра соматической (телесной) клетки и введение его в яйцеклетку, у которой было удалено ядро
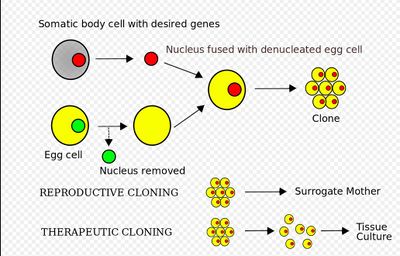
Использование подхода, основанного на протоколе, изложенном Тачибаной и др., hESCs могут быть получены с помощью СКНТ с использованием ядер дермальных фибробластов как от 35-летнего мужчины среднего возраста, так и от пожилого, 75-летнего мужчины, предполагая, что возрастные изменения не обязательно препятствуют ядерному перепрограммированию человеческих клеток на основе СКНТ. такое перепрограммирование соматических клеток в плюрипотентное состояние обладает огромным потенциалом для регенеративной медицины . К сожалению, клетки, полученные с помощью этой технологии, потенциально не полностью защищены от иммунной системы пациента (донора ядер), поскольку они имеют ту же митохондриальную ДНК, что и донор ооцитов, а не митохондриальную ДНК пациента. Это снижает их ценность в качестве источника для аутологичной трансплантационной терапии стволовыми клетками, поскольку в настоящее время не ясно, может ли он индуцировать иммунный ответ пациента при лечении.
Индуцированные андрогенетические гаплоидные эмбриональные стволовые клетки могут использоваться вместо спермы для клонирования. Эти клетки, синхронизированные в фазе M и введенные в яйцеклетку, могут производить жизнеспособное потомство.
Эти разработки вместе с данными о возможности получения неограниченного количества ооцитов из митотически активных репродуктивных стволовых клеток открывают возможность промышленного производства трансгенных сельскохозяйственных животных. Повторное реклонирование жизнеспособных мышей с помощью метода SCNT, включающего ингибитор гистоновой деацетилазы, трихостатин, добавляемый в клеточную культуральную среду, показывает, что можно бесконечно реклонировать животных без видимого накопления перепрограммирования или геномных ошибок однако исследование технологий разработки сперматозоидов и яйцеклеток из стволовых клеток поднимает биоэтические вопросы.
Такие технологии могут также иметь далеко идущие клинические применения для преодоления цитоплазматических дефектов в ооцитах человека. например, технология смогла предотвратить унаследованное митохондриальное заболевание от передачи к будущим поколениям. Митохондриальный генетический материал передается от матери к ребенку. Мутации могут вызывать сахарный диабет, глухоту, нарушения зрения, желудочно-кишечные расстройства, болезни сердца, слабоумие и другие неврологические заболевания. Ядро из одной человеческой яйцеклетки было перенесено в другую, включая ее митохондрии, создавая клетку, которая могла бы рассматриваться как имеющая двух матерей. Затем яйцеклетки были оплодотворены, и полученные эмбриональные стволовые клетки несли обмененную митохондриальную ДНК. В качестве доказательства того, что методика безопасна автор этого метода указывает на существование здоровых обезьян, которым сейчас более четырех лет – и которые являются продуктом митохондриальных трансплантатов на разных генетических фонах.
В мышах позднего поколения теломеразодефицитных (Terc -/ -), SCNT− опосредованное перепрограммирование уменьшает дисфункцию теломер и митохондриальные дефекты в большей степени, чем перепрограммирование на основе iPSC.
Были описаны и другие достижения в области клонирования и тотипотентной трансформации.
Получено без SCNT[править]
В последнее время некоторым исследователям удалось получить тотипотентные клетки без помощи SCNT. Тотипотентные клетки были получены с использованием эпигенетических факторов, таких как зародышевая изоформа гистона ооцитов. Перепрограммировать внутри-vivo, транзиторной индукцией 4 факторов Oct4, Sox2, Klf4 и c-Myc в мышах, совещается характеристики totipotency. Внутрибрюшинная инъекция таких клеток ИПС in vivo генерирует эмбриоподобные структуры, которые экспрессируют эмбриональные и экстраэмбриональные ( трофэктодермальные ) маркеры. Потенциал развития мышиных плюрипотентных стволовых клеток для получения как эмбриональных, так и экстраэмбриональных линий также может быть расширен дефицитом микроРНК miR-34a, приводящим к сильной индукции эндогенных ретровирусов MuERV-L (MERVL).
Омоложение до iPSCs[править]
Основная статья: Индуцированные плюрипотентные стволовые клетки
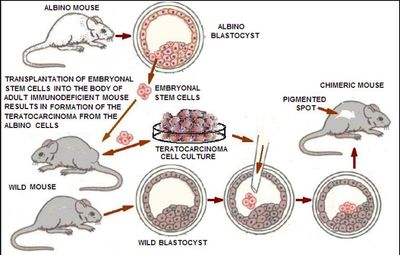
ИПСК были впервые получены в виде трансплантируемой тератокарциномы, индуцированной трансплантатами, взятыми из эмбрионов мыши. Тератокарцинома формируется из соматических клеток. генетически мозаичные мыши были получены из клеток злокачественной тератокарциномы, что подтверждает плюрипотентность клеток. оказалось, что клетки тератокарциномы способны поддерживать культуру плюрипотентных эмбриональных стволовых клеток в недифференцированном состоянии, снабжая питательную среду различными факторами. В 1980-х годах стало ясно, что пересадка плюрипотентных/эмбриональных стволовых клеток в организм взрослых млекопитающих , как правило, приводит к образованию тератом, которые затем могут превратиться в злокачественную опухоль тератокарциномы. однако, помещая клетки тератокарциномы в эмбрион на стадии бластоцисты, они становились включенными во внутреннюю клеточную массу и часто производили нормальное химерное (т. е. состоящее из клеток разных организмов) животное. Это указывало на то, что причиной возникновения тератомы является диссонанс - взаимное непонимание между молодыми донорскими клетками и окружающими взрослыми клетками (так называемая " ниша "реципиента).
В августе 2006 года японские исследователи обошли потребность в яйцеклетке, как и в SCNT. Перепрограммируя эмбриональные фибробласты мыши в плюрипотентные стволовые клетки посредством эктопической экспрессии четырех транскрипционных факторов , а именно Oct4 , Sox2 , Klf4 и c-Myc, они доказали, что чрезмерная экспрессия небольшого числа факторов может подтолкнуть клетку к переходу в новое стабильное состояние, связанное с изменениями активности тысяч генов
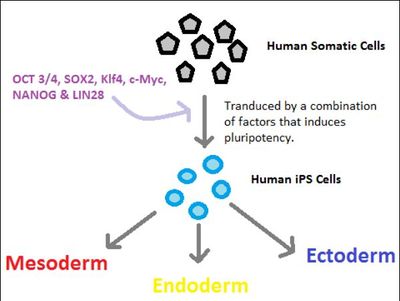
Таким образом, механизмы перепрограммирования связаны, а не независимы и сосредоточены на небольшом количестве генов. Свойства IPSC очень похожи на ЭСК. было показано, что IPSC поддерживают развитие мышей all-iPSC с использованием тетраплоидного (4n) эмбриона, наиболее строгий анализ потенциала развития. Однако некоторые генетически нормальные IPSC не смогли произвести мышей all-iPSC из-за аберрантного эпигенетического замалчивания импринтированного кластера Dlk1-Dio3 гена. Команда, возглавляемая Хансом Шолером (который открыл ген Oct4 еще в 1989 году), показала, что чрезмерная экспрессия Oct4 приводит к массивной активации гена вне мишени во время перепрограммирования, ухудшая качество IPSC. По сравнению с ОСКМ (Oct4, Sox2, Klf4 и с-ТУС), которые показывают аномальные импринтинга и дифференциация моделей, СКМ (Sox2, Klf4 и с-ТУС) создает перепрограммирования индуцированных плюрипотентных стволовых клеток с высоким развивающим потенциалом (почти в 20 раз выше, чем у ОСКМ) эквивалентно эмбриональных стволовых клеток, а определяется их способностью генерировать все-ИПСК мыши через тетраплоидных эмбрионов дополнения
Важным преимуществом iPSC по сравнению с ESC является то, что они могут быть получены из взрослых клеток, а не из эмбрионов. Поэтому стало возможным получать ИПСК от взрослых и даже пожилых пациентов.
Перепрограммирование соматических клеток на iPSC приводит к омоложению. Установлено, что перепрограммирование приводит к удлинению теломер и последующему их укорочению после дифференцировки обратно в фибробластоподобные производные. таким образом, перепрограммирование приводит к восстановлению длины эмбриональных теломер и, следовательно, увеличивает потенциальное число клеточных делений, в противном случае ограниченное пределом Хейфлика .
Однако из-за диссонанса между омоложенными клетками и окружающей нишей старых клеток реципиента инъекция его собственного ИПСК обычно приводит к иммунному ответу [77], который может быть использован в медицинских целях или образованию опухолей, таких как тератома. была выдвинута гипотеза о том, что некоторые клетки, дифференцированные от ESC и iPSC in vivo, продолжают синтезировать изоформы эмбриональных белков .Таким образом, иммунная система может обнаруживать и атаковать клетки, которые не сотрудничают должным образом.
Небольшая вызванная молекула Митоблок-6 может принудить плюрипотентные стволовые клетки умереть путем вызывать апоптоз (через отпуск цитохрома к через митохондриальное наружная мембрана) в плюрипотентных стволовых клетках человека, но не в дифференцированных клетках. Вскоре после дифференцировки дочерние клетки становились устойчивыми к смерти. Когда Митоблок-6 был введен в дифференцированные клеточные линии, клетки оставались здоровыми. Было выдвинуто предположение, что ключ к их выживанию лежит в изменениях, претерпеваемых митохондриями плюрипотентных стволовых клеток в процессе клеточной дифференцировки. Эта способность Митоблока-6 отделять плюрипотентные и дифференцированные клеточные линии имеет потенциал для снижения риска развития тератом и других проблем в регенеративной медицине.
В 2012 году были идентифицированы другие малые молекулы (селективные цитотоксические ингибиторы плюрипотентных стволовых клеток человека-hPSCs), которые предотвращали образование тератом человеческими плюрипотентными стволовыми клетками у мышей. Наиболее мощное и селективное соединение из них (Плюризин #1) ингибирует стеароил-коа десатуразу (ключевой фермент в биосинтезе олеиновой кислоты), что в конечном итоге приводит к апоптозу. С помощью этой молекулы недифференцированные клетки могут быть избирательно удалены из культуры. Эффективной стратегией для селективного устранения плюрипотентных клеток с потенциалом тератомы является таргетинг плюрипотентных стволовых клеток-специфических антиапоптотических факторов (например, survivin или Bcl10). Однократное лечение химическими ингибиторами survivin (например, кверцетином или YM155) может индуцировать селективную и полную гибель клеток недифференцированных ВПЧ и считается достаточным для предотвращения образования тератомы после трансплантации. однако маловероятно, что какой-либо предварительный зазор, имеет возможность защитить пересадку iPSC или ESC. После селективного удаления плюрипотентных клеток они быстро восстанавливаются, возвращая дифференцированные клетки в стволовые клетки, что приводит к опухолям. это может быть связано с нарушением регуляции let-7 его целевого Nr6a1 (также известного как ядерный фактор зародышевой клетки - GCNF), эмбрионального транскрипционного репрессора генов плюрипотентности, который регулирует экспрессию генов во взрослых фибробластах после потери микроРНК miRNA.
Образование тератомы плюрипотентными стволовыми клетками может быть вызвано низкой активностью фермента PTEN, который, как сообщается, способствует выживанию небольшой популяции (0,1–5% от общей популяции) высоко опухолевых, агрессивных, инициирующих тератомы эмбриональных карциномных клеток во время дифференцировки. Выживаемость этих инициирующих тератому клеток связана с неудавшейся репрессией Nanog, а также склонностью к повышенному метаболизму глюкозы и холестерина. эти тератома-инициирующие клетки также выражали более низкое соотношение р53/Р21 по сравнению с не-опухолевыми клетками.[89] В связи с вышеуказанными проблемами безопасности, использование iPSC для клеточной терапии все еще ограничено. однако они могут быть использованы для различных других целей - в том числе для моделирования заболеваний, скрининга (селективного отбора) лекарственных средств, тестирования токсичности различных лекарственных средств
Ткани, выращенные из ИПСК, помещенные в "химерные" эмбрионы на ранних стадиях развития мыши, практически не вызывают иммунного ответа (после того, как эмбрионы выросли во взрослых мышей) и пригодны для аутологичной трансплантации В то же время полное перепрограммирование взрослых клеток in vivo в тканях путем транзиторной индукции четырех факторов Oct4, Sox2, Klf4 и c-Myc у мышей приводит к появлению тератом из нескольких органов. Кроме того, частичное перепрограммирование клеток в сторону плюрипотентности in vivo у мышей демонстрирует, что неполное перепрограммирование влечет за собой эпигенетические изменения (неудавшуюся репрессию Поликомб-мишеней и измененное метилирование ДНК ) в клетках, которые управляют развитием рака.
Химическая стимуляция[править]
Основная статья: Химическая биология § Химические подходы к биологии стволовых клеток
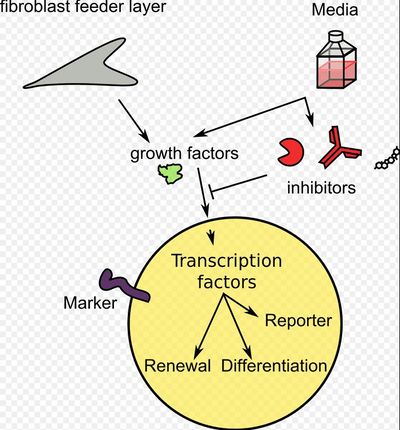
Используя исключительно малые молекулы, Дэн Хункуй и его коллеги продемонстрировали, что эндогенных "главных генов" достаточно для перепрограммирования клеточной судьбы. Они индуцировали плюрипотентное состояние во взрослых клетках у мышей с использованием семи мелкомолекулярных соединений. Эффективность метода достаточно высока: он смог конвертировать 0,02% клеток взрослой ткани в ИПСК, что сопоставимо с коэффициентом конверсии инсерции генов. Авторы отмечают, что мыши, полученные из Ципск, были "на 100% жизнеспособны и, по-видимому, здоровы в течение 6 месяцев". Таким образом, эта химическая стратегия перепрограммирования имеет потенциальное применение в создании функциональных желательных типов клеток для клинических применений.
В 2015 году была создана надежная система химического перепрограммирования с выходом до 1000-кратного больше, чем у ранее представленного протокола. Итак, химическое перепрограммирование стало многообещающим подходом к манипулированию судьбами клеток.
Дифференцировка от индуцированной тератомы[править]
Тот факт, что ИПСК человека способны образовывать тератомы не только у человека, но и в организме некоторых животных, в частности у мышей или свиней, позволил разработать метод дифференцировки ИПСК in vivo. С этой целью ИПСК с агентом для индуцирования дифференцировки в клетки-мишени вводят генетически модифицированной свинье или мыши, которая подавила активацию иммунной системы на клетках человека. Сформированная тератома вырезается и используется для выделения необходимых дифференцированных клеток человека с помощью моноклонального антитела к тканеспецифическим маркерам на поверхности этих клеток. Этот метод был успешно использован для производства функциональных миелоидных, эритроидных и лимфоидных клеток человека, пригодных для трансплантации (пока только мышам). Мыши, привитые человеческими тератомными кроветворными клетками iPSC, продуцировали человеческие В-и Т-клетки, способные к функциональным иммунным реакциям. Эти результаты дают надежду на то, что in vivo генерация индивидуальных клеток пациента осуществима, предоставляя материалы, которые могут быть полезны для трансплантации, генерации антител человека и применения для скрининга лекарств. Использование Митоблока-6 и / или Плюризин # 1 дифференцированные клетки-предшественники могут быть дополнительно очищены от тератомы, образующей плюрипотентные клетки. Тот факт, что дифференцировка происходит даже в тератомной нише, дает надежду на то, что полученные клетки достаточно устойчивы к раздражителям, способным вызвать их переход обратно в дедифференцированное (плюрипотентное) состояние и поэтому безопасны. Аналогичная система дифференцировки in vivo, дающая приживляемые гемопоэтические стволовые клетки от мышиных и человеческих ИПСК у тератомоносных животных в сочетании с маневром для облегчения гемопоэза, была описана Suzuki et al. Они отметили, что ни лейкемия, ни опухоли не наблюдались у реципиентов после внутривенного введения полученных из ИПСК гемопоэтических стволовых клеток облученным реципиентам. Кроме того, эта инъекция привела к мультилинейности и длительному восстановлению гематолимфопоэтической системы при последовательных передачах. Такая система является полезным инструментом для практического применения ИПСК в лечении гематологических и иммунологических заболеваний.
Для дальнейшего развития этого метода животное, в котором выращивается клеточный трансплантат человека, например мышь, должно иметь настолько модифицированный геном, что все его клетки экспрессируют и имеют на своей поверхности человеческий SIRPa . Для предотвращения отторжения после трансплантации пациенту аллогенного органа или ткани, выращенного из плюрипотентных стволовых клеток in vivo у животного, эти клетки должны экспрессировать две молекулы: CTLA4-Ig , который нарушает костимуляторные пути Т-клеток и PD-L1 , который активирует Т-клеточный ингибиторный путь.
Смотрите также: патент США 20130058900.
Дифференцированные типы ячеек[править]
Ретинальные клетки[править]
В ближайшем будущем начнутся клинические испытания, призванные продемонстрировать безопасность применения ИПСК для клеточной терапии людей с возрастной макулярной дегенерацией-заболеванием, вызывающим слепоту через повреждение сетчатки. Существует несколько статей, описывающих способы получения ретинальных клеток из iPSCs и как их использовать для клеточной терапии. сообщения о трансплантации ретинального пигментированного эпителия, полученного из iPSC, показали усиление визуально-ориентированное поведение экспериментальных животных в течение 6 недель после трансплантации. Тем не менее, клинические испытания были успешными: у десяти пациентов, страдающих пигментным ретинитом, было восстановлено зрение, в том числе у женщины, у которой осталось только 17 процентов ее зрения.
Эпителиальные клетки легких и дыхательных[править]
Хронические заболевания легких, такие как идиопатический легочный фиброз и кистозный фиброз или хроническая обструктивная болезнь легких и астма, являются ведущими причинами заболеваемости и смертности во всем мире со значительным человеческим, социальным и финансовым бременем. Поэтому существует острая необходимость в эффективной клеточной терапии и легочной тканевой инженерии . Было разработано несколько протоколов для генерации большинства типов клеток дыхательной системы, которые могут быть полезны для получения специфичных для пациента терапевтических клеток.
Репродуктивные клетки[править]
Некоторые линии ИПСК обладают способностью дифференцироваться в мужские зародышевые клетки и ооцитоподобные клетки в соответствующей нише (путем культивирования в среде для дифференцировки ретиноевой кислоты и свиной фолликулярной жидкости или трансплантации семенных канальцев). Кроме того, трансплантация ИПСК вносит свой вклад в восстановление семенника бесплодных мышей, демонстрируя потенциальную возможность получения гамет из ИПСК in vivo и in vitro.
Индуцированные прогениторные стволовые клетки[править]
Прямая трансдифференциация[править]
Риск возникновения рака и опухолей создает необходимость разработки методов получения более безопасных клеточных линий, пригодных для клинического использования. Альтернативным подходом является так называемое" прямое перепрограммирование " – трансдифференцировка клеток без прохождения через плюрипотентное состояние. основанием для такого подхода послужило то, что 5 – азацитидин-реагент для деметилирования ДНК-может вызывать образование миогенных, хондрогенных и адипогенных клонов в бессмертной клеточной линии эмбриональных фибробластов мыши и что для такого перепрограммирования достаточно активации одного гена, позже названного MyoD1. по сравнению с iPSC, чье перепрограммирование требует не менее двух недель, образование индуцированных клеток-предшественников иногда происходит в течение нескольких дней, и эффективность перепрограммирования обычно во много раз выше. Это перепрограммирование не всегда требует деления клеток. клетки, полученные в результате такого перепрограммирования, более пригодны для клеточной терапии, поскольку они не образуют тератомы. Например, Чандракантан и др., & Pimanda описывают генерацию тканерегенеративных мультипотентных стволовых клеток (iMS-клеток) путем временной обработки зрелых костных и жировых клеток с помощью фактора роста (тромбоцитарного фактора роста- AB (PDGF-AB)) и 5-Азацитидин. Эти авторы утверждают, что:" в отличие от первичных мезенхимальных стволовых клеток, которые используются с небольшим количеством объективных доказательств в клинической практике для содействия репарации тканей, iMS-клетки вносят непосредственный вклад в in vivo регенерацию тканей контекстно-зависимым образом без образования опухолей "и поэтому" имеет значительный объем для применения в регенерации тканей."
Один транскрипционный фактор transdifferentiation[править]
Первоначально только ранние эмбриональные клетки можно было уговорить изменить их идентичность. Зрелые клетки устойчивы к изменению своей идентичности, как только они привязаны к определенному виду. Однако кратковременная экспрессия одного транскрипционного фактора, фактора ELT-7 GATA, может преобразовать идентичность полностью дифференцированных, специализированных неэндодермальных клеток глотки в полностью дифференцированные кишечные клетки у интактных личинок и взрослых круглых червей Caenorhabditis elegans без требования к дедифференцированному промежуточному звену.
Трансдифференцирование с активатором, опосредованным CRISPR[править]
Судьба клетки может быть эффективно манипулирована редактированием эпигенома. В частности, путем непосредственной активации специфической эндогенной экспрессии гена CRISPR-опосредованным активатором. Когда dCas9 (который был модифицирован таким образом, что он больше не разрезает ДНК, но все еще может направляться к определенным последовательностям и связываться с ними) сочетается с активаторами транскрипции, он может точно манипулировать эндогенной экспрессией генов. Используя этот метод, Wei et al., повышенная экспрессия эндогенных Cdx2 и Gata6 гены CRISPR-опосредованных активаторов, таким образом, непосредственно преобразуют эмбриональные стволовые клетки мыши в две экстраэмбриональные линии, т. е. типичные стволовые клетки трофобласта и экстраэмбриональные клетки эндодермы. аналогичный подход был использован для индукции активации эндогенных генов Brn2, Ascl1 и Myt1l для преобразования эмбриональных фибробластов мыши в индуцированные нейрональные клетки. Таким образом, транскрипционная активация и эпигенетическое ремоделирование эндогенных основных факторов транскрипции являются достаточными для конверсии между типами клеток. Быстрая и устойчивая активация эндогенных генов в контексте их нативного хроматина с помощью этого подхода может облегчить перепрограммирование с помощью переходных методов, которые избегают геномной интеграции и обеспечивают новую стратегию преодоления эпигенетических барьеров для спецификации судьбы клетки.
Поэтапное моделирование процесса регенерации[править]
Другим способом перепрограммирования является моделирование процессов, происходящих при регенерации конечностей амфибии. У уродельских амфибий ранним этапом регенерации конечностей является дедифференцировка скелетных мышечных волокон в клетчатку, которая пролиферирует в ткани конечностей. Однако последовательная мелкомолекулярная обработка мышечного волокна миосеверином, реверсином (ингибитор киназы aurora B) и некоторыми другими химическими веществами: BIO (ингибитор гликогенсинтазы-3 киназы), лизофосфатидиновой кислотой (плейотропный активатор G-белок-связанных рецепторов), SB203580 (ингибитор киназы P38 MAP) или SQ22536 (ингибитор аденилциклазы) вызывает образование новых типов мышечных клеток, а также других типов клеток, таких как предшественники клеток жировой, костной и нервной систем.
Трансдифференцирование на основе антител[править]
Исследователи обнаружили, что антитела, имитирующие GCSF, могут активировать ростостимулирующий рецептор на клетках костного мозга таким образом, что он индуцирует стволовые клетки костного мозга, которые обычно развиваются в белые клетки крови, чтобы стать нейронными прогениторными клетками. Методика позволяет исследователям осуществлять поиск больших библиотек антител и быстро подбирать те, которые обладают желаемым биологическим эффектом.
Перепрограммирование бактериями[править]
Желудочно-кишечный тракт человека колонизирован обширным сообществом симбионтов и комменсалов. Исследователи демонстрируют феномен перепрограммирования соматических клеток бактериями и генерацию мультипотентных клеток из клеток фибробластов кожи взрослого человека путем включения молочнокислых бактерий эта клеточная трансдифференцировка вызвана рибосомами и "может происходить через донорские бактерии, которые проглатываются и перевариваются клетками-хозяевами, что может индуцировать рибосомный стресс и стимулировать клеточную пластичность развития."
Условно перепрограммированные ячейки[править]
Шлегель и Лю продемонстрировали, что комбинация фидерных клеток и ингибитора Rho киназы (Y-27632) индуцирует нормальные и опухолевые эпителиальные клетки из многих тканей, чтобы пролиферировать бесконечно in vitro. Этот процесс происходит без необходимости трансдукции экзогенных вирусных или клеточных генов. Эти клетки были названы " условно перепрограммированными клетками (CRC)". Индукция CRCs происходит быстро и является результатом перепрограммирования всей популяции клеток. CRCs не экспрессируют высокие уровни белков, характерных для iPSCs или эмбриональных стволовых клеток (ЭСК) (например, Sox2, Oct4, Nanog или Klf4). Эта индукция CRCs реверзибельна и удаление Y-27632 и фидеров позволяет клеткам продифференцировать нормально. технология CRC может генерировать 2 × 10 6 клеток за 5-6 дней от биопсии иглы и может генерировать культуры из криоконсервированной ткани и из менее чем четырех жизнеспособных клеток. КРК сохраняют нормальный кариотип и остаются нетуморигенными. Этот метод также эффективно устанавливает культуры клеток из опухолей человека и грызунов.
Способность быстро генерировать большое количество опухолевых клеток из небольших биопсийных образцов и замороженных тканей предоставляет значительные возможности для клеточной диагностики и терапии (в том числе для определения химиочувствительности) и значительно расширяет ценность биобанкинга. используя технологию CRC, исследователи смогли определить эффективную терапию для пациента с редким типом опухоли легких. группа англичанина описывает фармакогеномную платформу, которая облегчает быстрое обнаружение комбинаций лекарственных средств, которые могут преодолеть сопротивление с помощью системы CRC. Кроме того, метод CRC позволяет проводить генетическую манипуляцию эпителиальными клетками ex vivo и их последующую оценку in vivo в том же хозяине. В то время как первоначальные исследования показали, что совместное культивирование эпителиальных клеток со швейцарскими 3t3 клетками J2 было необходимо для индукции CRC, с трансвелловскими культуральными пластинами физический контакт между питателями и эпителиальными клетками не требуется для индукции CRC и, что еще более важно, для этой индукции требуется облучение питательных клеток. В соответствии с экспериментами transwell, кондиционированная среда индуцирует и поддерживает CRCs, что сопровождается сопутствующим повышением активности клеточной теломеразы. Активность кондиционированной среды напрямую коррелирует с радиационно-индуцированным апоптозом питательных клеток. Таким образом, условное перепрограммирование эпителиальных клеток опосредовано комбинацией Y-27632 и растворимого фактора(ов), высвобождаемого апоптотическими питательными клетками.
Riegel et al. демонстрируют, что мышиные клетки ME, выделенные из нормальных молочных желез или из вируса опухоли молочной железы мыши (MMTV)-Neu–индуцированных опухолей молочной железы, могут культивироваться бесконечно в качестве условно перепрограммированных клеток (CRCs). Маркеры клеточной поверхности, ассоциированные с прародителями, быстро индуцируются в нормальных мышиных ME-CRCs относительно клеток ME. Однако экспрессия некоторых субпопуляций предшественников молочной железы, таких как CD49f+ ESA+ CD44+, значительно снижается в более поздних пассажах. Тем не менее, мышиные ME-CRC, выращенные в трехмерном внеклеточном матриксе, дали начало ацинарным структурам молочной железы. ME-CRCs, выделенные из трансгенных опухолей молочной железы мышей линии MMTV-Neu, экспрессируют высокие уровни HER2/neu, а также маркеров опухолевых клеток, таких как CD44+, CD49f+ и ESA+ (EpCam). Эти паттерны выражения поддерживаются в более поздних пассажах CRC. Раннее и позднее прохождение ME-CRCs от опухолей MMTV-Neu, которые были имплантированы в молочные жировые подушки сингенных или обнаженных мышей, привело к развитию сосудистых опухолей, которые метастазировали в течение 6 недель после трансплантации. Важно отметить, что гистопатология этих опухолей была неотличима от родительских опухолей, которые развиваются у мышей с MMTV-Neu. Применение системы CRC к клеткам эпителия молочной железы мыши обеспечивает привлекательную модельную систему для изучения генетики и фенотипа нормального и трансформированного эпителия мыши в определенной культуральной среде и в исследованиях трансплантации in vivo.
Другой подход к CRC заключается в ингибировании CD47-мембранного белка, который является рецептором тромбоспондина-1. Потеря CD47 позволяет поддерживать устойчивую пролиферацию первичных эндотелиальных клеток мышей, увеличивает асимметричное деление и позволяет этим клеткам спонтанно перепрограммировать для формирования мультипотентных эмбриоидных телоподобных кластеров. Нокдаун CD47 остро увеличивает мРНК уровни c-Myc и других факторов транскрипции стволовых клеток в клетках in vitro и in vivo. Тромбоспондин-1 является ключевым сигналом окружающей среды, который ингибирует самообновление стволовых клеток через CD47. Таким образом, антагонисты CD47 позволяют клеткам самообновляться и перепрограммироваться, преодолевая негативную регуляцию c-Myc и других факторов транскрипции стволовых клеток. in vivo блокада CD47 с использованием антисмыслового морфолино увеличивает выживаемость мышей, подвергшихся смертельному тотальному облучению организма за счет повышения пролиферативной способности клеток костного мозга и радиопротекции радиочувствительных тканей желудочно-кишечного тракта.
Усилители, зависящие от происхождения[править]
Дифференцированные макрофаги могут самообновляться в тканях и длительно расширяться в культуре. при определенных условиях макрофаги могут делиться, не теряя приобретенных ими свойств, специализируясь на иммунных клетках, что обычно невозможно с дифференцированными клетками . Макрофаги достигают этого путем активации генной сети, подобной той, что обнаружена в эмбриональных стволовых клетках. Анализ одной клетки показал, что, in vivo пролиферирующие макрофаги могут депрессировать репертуар специфических для макрофагов усилителей, связанных с сетью генов, контролирующих самообновление. Это произошло, когда концентрации двух транскрипционных факторов, названных MafB и c-Maf, были естественно низкими или ингибировались в течение короткого времени. Генетические манипуляции, которые выключили MafB и c-Maf в макрофагах, заставили клетки начать программу самообновления. Подобная сеть также контролирует самообновление эмбриональных стволовых клеток, но связана с различными эмбриональными стволовыми клетками-специфическими усилителями.
Таким образом, макрофаги, выделенные из MafB - и c-Maf-двойных дефицитных мышей, делятся бесконечно; самообновление зависит от c-Myc и Klf4 .
Косвенное преобразование родословной[править]
Косвенная конверсия линий представляет собой методику перепрограммирования, в которой соматические клетки переходят через пластическое промежуточное состояние частично перепрограммированных клеток (pre-iPSC), индуцированное кратковременным воздействием факторов перепрограммирования с последующей дифференцировкой в специально разработанной химической среде (искусственной нише).
Этот метод может быть как более эффективным, так и более безопасным, поскольку он, как представляется, не вызывает опухолей или других нежелательных генетических изменений и приводит к гораздо большей отдаче, чем другие методы. Однако безопасность этих камер остается под вопросом. Поскольку преобразование линий от пре-iPSC зависит от использования условий перепрограммирования iPSC, часть клеток может приобрести плюрипотентные свойства, если они не остановят процесс де-дифференцировки in vitro или из-за дальнейшей де-дифференцировки in vivo.
Гликопротеин наружной мембраны[править]
Общей особенностью плюрипотентных стволовых клеток является специфический характер белкового гликозилирования их наружной мембраны. Это отличает их от большинства неплюрипотентных клеток, хотя и не белых кровяных телец . гликаны на поверхности стволовых клеток быстро реагируют на изменения состояния клеток и сигнализацию и поэтому идеально подходят для выявления даже незначительных изменений в клеточных популяциях. Многие маркеры стволовых клеток основаны на поверхностных гликановых эпитопах клеток , включая широко используемые маркеры SSEA-3, SSEA-4, Tra 1-60 и Tra 1-81. Suila Heli et al. предполагают, что в человеческих стволовых клеток внеклеточных о-GlcNAc и внеклеточных о-LacNAc, играют решающую роль в доработке Нотч сигнального пути - высоко консервативный клеточной сигнальной системы, которая регулирует клеточный судьба спецификации, дифференциации, лево–правой асимметрии, апоптоз, somitogenesis и ангиогенез играет ключевую роль в клеточной пролиферации (обзор Perdigoto и Бардин и Джафар-Неджад и соавт.)
Изменения гликозилирования белков наружной мембраны являются маркерами состояний клеток, так или иначе связанных с плюрипотентностью и дифференцировкой. изменение гликозилирования, по-видимому, является не только результатом инициализации экспрессии генов, но и выполняет роль важного генетического регулятора, участвующего в приобретении и поддержании недифференцированного состояния.
Например, активация гликопротеина ACA, связывающего гликозилфосфатидилинозитол на поверхности клеток-предшественников в периферической крови человека, индуцирует повышенную экспрессию генов Wnt, Notch-1 , BMI1 и HOXB4 через сигнальный каскад PI3K / Akt / mTor / PTEN и способствует формированию самообновляющейся популяции гемопоэтических стволовых клеток.
Кроме того, дедифференцировка клеток-предшественников, индуцированная ACA-зависимым сигнальным путем, приводит к появлению ACA-индуцированных плюрипотентных стволовых клеток, способных дифференцироваться in vitro в клетки всех трех зародышевых слоев . Изучение способности лектинов поддерживать культуру плюрипотентных стволовых клеток человека привело к открытию лектина Erythrina crista-galli (ECA), который может служить простой и высокоэффективной матрицей для культивирования плюрипотентных стволовых клеток человека.
Перепрограммирование с помощью физического подхода[править]
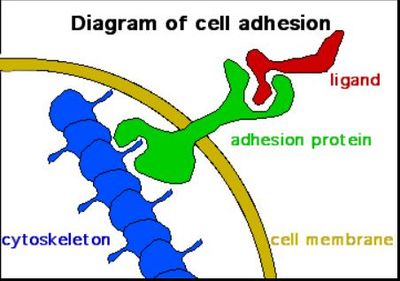
Белок клеточной адгезии е-кадгерин незаменим для надежного плюрипотентного фенотипа . во время перепрограммировать для поколения клетки ИПС, Н-кадхерин может заменить функцию е-кадхерина. эти функции кадгерина напрямую не связаны с адгезией, поскольку морфология сферы помогает поддерживать "стволовость" стволовых клеток. Кроме того, образование сфер, обусловленное принудительным ростом клеток на низкой поверхности прикрепления, иногда вызывает перепрограммирование. Например, нейронные клетки-предшественники могут быть получены из фибробластов непосредственно с помощью физического подхода без введения экзогенных факторов перепрограммирования.
Физические сигналы, в виде параллельных микрогроов на поверхности клеточно-адгезивных подложек, могут заменить эффекты мелкомолекулярных эпигенетических модификаторов и значительно повысить эффективность перепрограммирования. Этот механизм основан на механомодуляции эпигенетического состояния клеток. В частности, "снижение активности гистоновой дезацетилазы и повышение уровня экспрессии WD – повтора домена 5 (WDR5) – субъединицы метилтранферазы Н3-микрогранулированными поверхностями приводят к усилению ацетилирования и метилирования гистона Н3". Нановолокнистые каркасы с выровненной ориентацией волокон производят эффекты, аналогичные тем, которые производятся микрогроувами, предполагая, что изменения в морфологии клеток могут быть ответственны за модуляцию эпигенетического состояния
Жесткость субстрата является важным биофизическим сигналом, влияющим на нейронную индукцию и спецификацию подтипа. Например, мягкие субстраты способствуют нейроэпителиальной конверсии, ингибируя дифференцировку нервных гребней hESCs в BMP4-зависимом порядке. Механистические исследования выявили многоцелевой механотрансдуктивный процесс, включающий механосенсибилизирующее фосфорилирование Smad и нуклеоцитоплазматическое свертывание, регулируемое жесткостезависимой активностью Hippo /YAP и целостность и сократительную способность цитоскелета актомиозина.
Эмбриональные стволовые клетки мыши (mESCs) подвергаются самообновлению в присутствии ингибирующего фактор лейкоза цитокинов (LIF). После выведения LIF происходит дифференцировка Меск, сопровождающаяся повышением адгезии клетка-субстрат и распространением клеток. Ограниченное распространение клеток в отсутствие LIF путем культивирования Меск на химически определенных, слабо адгезивных биосубстратах или манипулирования цитоскелетом это позволило клеткам оставаться в недифференцированном и плюрипотентном состоянии. Влияние ограниченного распространения клеток на самообновление Меск не опосредовано повышенной межклеточной адгезией, так как ингибирование межклеточной адгезии с помощью функции блокирования анти-е-кадгеринового антитела или siRNA не способствует дифференцировке. Описаны возможные механизмы предопределения судьбы стволовых клеток физическими взаимодействиями с внеклеточным матриксом.
Был разработан новый метод, который позволяет быстрее и эффективнее превращать клетки в стволовые клетки, "сжимая" их с помощью жесткости 3D микроокружения и плотности окружающего геля. Метод может быть применен к большому количеству клеток для получения стволовых клеток медицинского назначения в промышленных масштабах.
Клетки, вовлеченные в процесс перепрограммирования, изменяются морфологически по мере его протекания. Это приводит к физической разнице в адгезивных силах между клетками. Существенные различия в "адгезивной сигнатуре" между плюрипотентными стволовыми клетками, частично перепрограммированными клетками, дифференцированным потомством и соматическими клетками позволили разработать способ разделения для выделения плюрипотентных стволовых клеток в микрофлюидных устройствах ,который является:
- быстро (разделение занимает менее 10 минут);
- эффективный (разъединение приводит к в культуре клетки ИПС больш чем 95 процентов чистой);
- безобидный (выживаемость клеток превышает 80 процентов, и в результате клетки сохраняют нормальные транскрипционные профили, потенциал дифференцировки и кариотип).
Стволовые клетки обладают механической памятью (они запоминают прошлые физические сигналы) – с факторами сигнального пути Гиппо: Yes-ассоциированным белком (YAP) и транскрипционным коактиватором с PDZ-связывающим доменом (TAZ), действующим как внутриклеточный механический реостат, который хранит информацию из прошлых физических сред и влияет на судьбу клеток.
Нервные стволовые клетки[править]
Инсульт и многие нейродегенеративные расстройства, такие как болезнь Паркинсона, Болезнь Альцгеймера, боковой амиотрофический склероз нуждаются в клеточной заместительной терапии. Успешное использование преобразованных нервных клеток (ЦНС) в трансплантациях открывает новые возможности для лечения таких заболеваний.[ тем не менее, индуцированные нейроны (ИНС), непосредственно преобразованные из фибробластов, являются терминально предрасположенными и проявляют очень ограниченную пролиферативную способность, которая может не обеспечивать достаточного количества аутологичных донорских клеток для трансплантации. Самообновляющиеся индуцированные нейральные стволовые клетки (ИНСК) обеспечивают дополнительные преимущества по сравнению с ИНС как для фундаментальных исследований, так и для клинических применений.
Например, в определенных условиях роста мышиные фибробласты могут быть перепрограммированы с помощью одного фактора Sox2, чтобы сформировать ИНСК, которые самообновляются в культуре и после трансплантации могут выжить и интегрироваться без образования опухолей в мозге мыши. ИНСК могут быть получены из фибробластов взрослого человека невирусными методами, что позволяет предложить безопасный метод для аутологичной трансплантации или для разработки клеточных моделей заболеваний.
Нейронные химически индуцированных прогениторных клеток (ciNPCs) могут быть получены от мыши хвост-совет фибробластов и человека мочевыделительную соматических клеток без введения экзогенных факторов, но - химическим коктейлем, а именно видеомагнитофон (в ВПА, является ингибитором HDACs; с, CHIR99021, является ингибитором ГСК-3 киназы и Р RepSox, ингибитор сигнальных путей ТФР бета), в соответствии с физиологической гипоксического состояния.[191] альтернативные коктейли с ингибиторами деацетилирования гистонов, киназы гликогенсинтазы и путей TGF-β (где: бутират натрия (NaB) или трихостатин А (TSA) могут заменить VPA, хлорид лития (LiCl) или карбонат лития (Li2CO3) смог заменить CHIR99021, или Repsox может быть заменено на SB-431542 или Tranilast ) показывают подобные эффективности для индукции ciNPC. Zhang, et al., также сообщают о высокоэффективном перепрограммировании мышиных фибробластов в индуцированные нейронные стволовые клеткоподобные клетки (ciNSLCs) с использованием коктейля из девяти компонентов.
Описаны многочисленные методы прямой трансформации соматических клеток в индуцированные нейронные стволовые клетки.
Доказательство принципа эксперименты демонстрируют, что можно преобразовать пересаженные человеческие фибробласты и человеческие астроциты непосредственно в головном мозге, которые спроектированы для экспрессии индуцибельных форм генов нейронного перепрограммирования, в нейроны , когда перепрограммирующие гены ( Ascl1, Brn2a и Myt1l ) активируются после трансплантации с использованием лекарственного средства.
Астроциты-наиболее распространенные нейроглиальные клетки головного мозга, которые способствуют образованию рубцов в ответ на травму – могут быть непосредственно перепрограммированы in vivo, чтобы стать функциональными нейронами, которые сформировали сети у мышей без необходимости трансплантации клеток.Исследователи следили за мышами в течение почти года, чтобы найти признаки образования опухоли, и сообщили, что ничего не нашли. Те же исследователи превратили астроциты, образующие рубцы, в клетки-предшественники, называемые нейробластами, которые регенерировали в нейроны в поврежденном взрослом спинном мозге.
Клетки-предшественники олигодендроцитов[править]
Без миелина, который изолирует нейроны, нервные сигналы быстро теряют силу. Болезни, которые атакуют миелин, такие как рассеянный склероз, приводят к нервным сигналам, которые не могут распространяться до нервных окончаний и, как следствие, приводят к когнитивным, моторным и сенсорным проблемам. Трансплантация клеток-предшественников олигодендроцитов (ОПК), которые могут успешно создавать миелиновые оболочки вокруг нервных клеток, является перспективным потенциальным терапевтическим ответом. Прямая линия преобразования фибробластов мыши и крысы в олигодендроглиальные клетки обеспечивает потенциальный источник ОПК. Преобразование путем принудительного выражения обоих восьми или из трех факторов транскрипции Sox10, Olig2 и Zfp536, возможно, обеспечивают такие клетки.
Кардиомиоциты[править]
Клеточная терапия in vivo может обеспечить трансформирующий подход для увеличения роста сосудов и мышц и предотвращения образования некратких рубцов путем доставки транскрипционных факторов или микроРНК в сердце. сердечные фибробласты, которые представляют собой 50% клеток в сердце млекопитающих, могут быть перепрограммированы в кардиомиоцитарные клетки in vivo путем местной доставки факторов транскрипции сердечного ядра ( GATA4, MEF2C, TBX5 и для улучшенного перепрограммирования плюс ESRRG, MESP1, Миокардин и ZFPM2) после коронарного лигирования . Эти результаты связаны с терапией, которая может непосредственно реанимировать сердце без трансплантации клеток. Однако эффективность такого перепрограммирования оказалась очень низкой, а фенотип полученных кардиомиоцитоподобных клеток не похож на фенотип зрелых нормальных кардиомиоцитов. Кроме того, трансплантация сердечных транскрипционных факторов в поврежденные сердца мышей приводила к плохой выживаемости клеток и минимальной экспрессии сердечных генов.
Между тем, успехи в методах получения миоцитов сердца in vitro произошли. эффективная сердечная дифференцировка клеток ИПС человека привела к появлению предшественников, которые были сохранены в инфарктных сердцах крыс и уменьшили ремоделирование сердца после ишемического повреждения.
Команда ученых, которую возглавлял Шэн Дин, использовала коктейль из девяти химических веществ (9C) для трансдифференцировки клеток кожи человека в клетки бьющегося сердца. С помощью этого метода более 97% клеток начали биться, что характерно для полностью развитых, здоровых клеток сердца. Химически индуцированные кардиомиоцитарные клетки (ciCMs) равномерно сокращались и напоминали человеческие кардиомиоциты по своим транскриптомным, эпигенетическим и электрофизиологическим свойствам. При пересадке в инфарктные сердца мышей, обработанные 9C фибробласты были эффективно преобразованы в ciCMs и развились в здоровые на вид клетки сердечной мышцы внутри органа. этот подход к химическому перепрограммированию, после дальнейшей оптимизации, может предложить простой способ обеспечить сигналы, которые побуждают сердечную мышцу регенерировать локально.
В другом исследовании ишемическая кардиомиопатия в модели инфаркта миокарда у мышей была нацелена на трансплантацию клеток iPS. Он синхронизировал отказывая желудочки, предлагая регенеративную стратегию для того чтобы достигнуть ресинхронизации и защиты от декомпенсации динт улучшенных левых проводимости и контрактильности желудочков, уменьшенного наносить шрам и реверсирования структурного ремоделирования.[207] Один протокол генерировал популяции до 98% кардиомиоцитов из hPSCs просто путем модуляции канонического сигнального пути Wnt в определенные моменты времени в процессе дифференцировки используют легкодоступные маломолекулярные соединения.
Открытие механизмов, контролирующих образование кардиомиоцитов, привело к разработке препарата итд-1, который эффективно очищает клеточную поверхность от TGF-β рецепторов II типа и избирательно ингибирует внутриклеточную TGF-β сигнализацию. Оно таким образом выборочно увеличивает дифференцировку uncommitted мезодермы к кардиомиоцитам, но не к васкулярным ровной мышце и эндотелиальным клеткам.
Один проект посеял децеллюляризованные сердца мышей с человеческими мультипотентными кардиоваскулярными прогениторными клетками, полученными из iPSC. Введенные клетки мигрировали, пролиферировали и дифференцировались in situ в кардиомиоциты, гладкомышечные клетки и эндотелиальные клетки для реконструкции сердца. Кроме того, внеклеточный матрикс сердца (субстрат каркаса сердца) сигнализировал о том, что клетки человека становятся специализированными клетками, необходимыми для правильной работы сердца. После 20 дней перфузии с факторами роста, проектированные ткани сердца начали бить снова и были отзывчивы к лекарствам.
Перепрограммирование сердечных фибробластов в индуцированные кардиомиоцитарные клетки (ИКК) in situ представляет собой перспективную стратегию для регенерации сердца. Мыши, подвергнутые в естественных условиях, до трех кардиологических факторов транскрипции мск (Gata4, Mef2c, Tbx5) и малых молекул: СБ-431542 (трансформирующего фактора роста (ТФР)-β ингибитор), и XAV939 (работой Wnt ингибитор) в течение 2 недель после инфаркта миокарда отмечено значительное улучшение перепрошивки (перепрограммирования эффективность увеличилась в восемь раз) и сердечная функция по сравнению с теми, подвергается только мск.
Смотрите также: Review
Омоложение мышечных стволовых клеток[править]
Пожилые люди часто страдают от прогрессирующей мышечной слабости и регенеративной недостаточности, что частично объясняется повышенной активностью митоген-активированного киназного пути p38a и p38ß в стареющих стволовых клетках скелетных мышц. Подвергая такие стволовые клетки транзиторному ингибированию р38а и р38β в сочетании с культурой на мягких гидрогелевых субстратах, они быстро расширяются и омолаживают их, что приводит к возвращению их прочности.
У гериатрических мышей покоящиеся сателлитные клетки теряют обратимый покой, переключаясь в необратимое предсеническое состояние, вызванное депрессией P16 INK4a (также называемой Cdkn2a). При травме эти клетки не активируются и не расширяются даже в молодом возрасте. глушение p16INK4a в гериатрических сателлитных клетках восстанавливает тишину и мышечные регенеративные функции.
Миогенные предшественники для потенциального использования в моделировании картины болезней или клеточных терапий пристреливая скелетных мышц также могут быть получены непосредственно из индуцированных плюрипотентных стволовых клеток с помощью свободно плавающих сферических культуры (эз сферах) в питательной среде, дополненной высоких концентрациях (100 нг/мл) фактор роста фибробластов-2 (ФРФ-2) и эпидермальный фактор роста.
Гепатоциты[править]
В отличие от современных протоколов получения гепатоцитов из фибробластов человека, Saiyong Zhu et al., (2014) не генерировал iPSCs, но, используя малые молекулы, прервал перепрограммирование на плюрипотентность для получения индуцированного мультипотентного состояния клетки-предшественника (iMPC), из которого эффективно дифференцировались эндодермальные клетки-предшественники и впоследствии гепатоциты (iMPC-Heps). После трансплантации в иммунодефицитную мышиную модель печеночной недостаточности человека, iMPC-гепатоциты пролиферировали экстенсивно и приобрели уровни функции гепатоцитов, аналогичные таковым у первичных взрослых гепатоцитов человека. импк-гепатоциты не образовывали опухолей, скорее всего потому, что они никогда не входили в плюрипотентное состояние.
Эти результаты устанавливают целесообразность значительной репопуляции печени мышей с человеческими гепатоцитами, генерируемыми in vitro, что устраняет давний блок на пути к аутологичной клеточной терапии печени.
Коктейль из малых молекул, Y-27632, A-83-01 ( ингибитор TGFß киназы/активина, подобный ингибитору киназы (ALK5)) и CHIR99021 (мощный ингибитор GSK-3 ), может конвертировать зрелые гепатоциты крыс и мышей in vitro в пролиферативные бипотентные клетки – клипсы (химически индуцированные предшественники печени). Клипсы могут дифференцироваться как в зрелые гепатоциты, так и в билиарные эпителиальные клетки, которые могут образовывать функциональные протоковые структуры. При длительном культивировании клипсы не теряют своей пролиферативной способности и способности к дифференцировке в печени, а также могут репопулировать хронически поврежденную ткань печени.
Клетки, продуцирующие инсулин[править]
Осложнения сахарного диабета , такие как сердечно-сосудистые заболевания , ретинопатия , невропатия, нефропатия и заболевания периферического кровообращения зависят от сахарной дисрегуляции из-за отсутствия инсулина из бета-клеток поджелудочной железы и могут быть смертельными, если их не лечить. Одним из перспективных подходов к пониманию и лечению диабета является использование плюрипотентных стволовых клеток (ПСК), в том числе эмбриональных стволовых клеток (ЭСК) и индуцированных ПСК (ИПСК). К сожалению, человеческие PSC-производные инсулин-экспрессирующие клетки напоминают человеческие фетальные β-клетки, а не взрослые β-клетки. В отличие от взрослых β-клеток, фетальные β-клетки кажутся функционально незрелыми, о чем свидетельствует повышенная базальная секреция глюкозы и отсутствие стимуляции глюкозой, что подтверждается РНК-seq транскриптов которых они содержат .
Альтернативной стратегией является конверсия фибробластов в отдельные эндодермальные популяции прогениторных клеток и, используя коктейли сигнальных факторов, успешная дифференцировка этих эндодермальных прогениторных клеток в функциональные бета-подобные клетки как in vitro, так и in vivo.
Чрезмерная экспрессия трех транскрипционных факторов, PDX1 (необходимых для роста почки поджелудочной железы и созревания бета-клеток), NGN3 (необходимых для образования эндокринных клеток-предшественников) и MAFA (для созревания бета-клеток) комбинация (называемая PNM) может привести к трансформации некоторых типов клеток в бета-клеточное состояние. Доступным и обильным источником функциональных инсулинпродуцирующих клеток является кишечник . Экспрессия PMN в кишечных " органоидах "человека стимулирует превращение эпителиоцитов кишечника в β-подобные клетки, возможно, приемлемые для трансплантации.
Нефронные прародители[править]
Взрослый проксимальных канальцах клетки напрямую транскрипционно перепрограммирован, чтобы нефрона предшественников из эмбриональной почки, используя пул из шести генов поучительных факторов транскрипции (SIX1, SIX2, OSR1, глаза отсутствуют гомолог 1(EYA1), Homeobox А11 (HOXA11) и улитка гомолог 2 (SNAI2)), который активировал гены согласуется с крышкой мезенхимы/нефрона прародитель фенотипа во взрослом проксимальных канальцах клеточной линии. Генерация таких клеток может привести к клеточной терапии для взрослых заболеваний почек. Эмбриональные почечные органоиды, помещенные в почки взрослых крыс, могут подвергаться дальнейшему развитию и развитию сосудов.
Клетки кровеносных сосудов[править]
По мере старения кровеносные сосуды часто становятся аномальными по своей структуре и функции, что способствует развитию многочисленных возрастных заболеваний, включая инфаркт миокарда, ишемический инсульт и атеросклероз артерий, снабжающих сердце, мозг и нижние конечности. Таким образом, важной задачей является стимулирование сосудистого роста для обеспечения коллатерального кровообращения, чтобы предотвратить обострение этих заболеваний. Индуцированные сосудистые прогениторные клетки (ivpc) полезны для клеточной терапии, предназначенной для стимулирования коронарного коллатерального роста. Они были созданы путем частичного перепрограммирования эндотелиальных клеток. Сосудистая приверженность ivpc связана с эпигенетической памятью эндотелиальных клеток, которая порождает их как клеточные компоненты растущих кровеносных сосудов. Именно поэтому при имплантации внутривенных капилляров в миокард они лучше прижились в кровеносных сосудах и увеличили коронарный коллатеральный поток, чем ИПСК, мезенхимальные стволовые клетки или нативные эндотелиальные клетки.
Ex vivo генетическая модификация может быть эффективной стратегией для повышения функции стволовых клеток. Например, клеточная терапия, использующая генетическую модификацию с помощью PIM –1 киназы (нисходящего эффектора Akt , который положительно регулирует неоваскулогенез) клеток костного мозга или кардиальных прогениторных клеток человека, выделенных из поврежденного миокарда , приводит к долговечности репарации, а также улучшению функциональных параметров гемодинамики миокарда.
Стволовые клетки, извлеченные из жировой ткани после липосакции, могут быть уговорены стать предшественниками гладкомышечных клеток (iPVSMCs), обнаруженных в артериях и венах.
В 2D культуре системе человеческих iPS-клеток в сочетании с тройной маркер выбора (СD34 (поверхность glycophosphoprotein выразил на развитии ранних эмбриональных фибробластов), НП1 (рецептор – neuropilin 1) и КДР (киназы вставить домен-содержащих рецепторов)) для изоляции васкулогенной клеток-предшественников из человеческих ИПСК, образующиеся эндотелиальные клетки, которые после трансплантации, сформирован стабильный, функциональный мышь кровеносных сосудов в естественных условиях, длится 280 дней.
Для лечения инфаркта важно предотвратить образование фиброзной рубцовой ткани. Это может быть достигнуто in vivo путем преходящего применения паракринных факторов, которые перенаправляют вклад нативных стволовых клеток-предшественников сердца из рубцовой ткани в сердечно-сосудистую ткань. Например, в модели инфаркта миокарда мыши, одиночная внутримиокардиальная впрыска человеческого васкулярного эндотелиального фактора роста а мРНК (VEGF-a modRNA), модифицированная для выхода из нормальной защитной системы организма, приводит к долгосрочному улучшению функции сердца за счет мобилизации и перенаправления эпикардиальных клеток-предшественников в сторону сердечно-сосудистых типов клеток.
Стволовые клетки крови[править]
Эритроциты[править]
Переливание РБК необходимо многим пациентам. Однако на сегодняшний день поставки РБК остаются нестабильными. Кроме того, переливание крови создает риск передачи инфекционных заболеваний. Большое количество безопасных РБК, полученных in vitro, помогло бы решить эту проблему. Ex vivo эритроидная генерация клеток может обеспечить альтернативные трансфузионные продукты для удовлетворения нынешних и будущих клинических требований. эритроциты (RBC)s, полученные in vitro из мобилизованных CD34-позитивных клеток, имеют нормальную выживаемость при переливании в аутологичного реципиента. РБК, полученный in vitro, содержал исключительно фетальный гемоглобин (HbF), который спасает функциональность этих РБК. In vivo переход фетального гемоглобина во взрослый наблюдался после инфузии нуклеированных эритроидных предшественников, полученных из ИПСК. хотя РБК не имеют ядер и поэтому не могут образовывать опухоль, их непосредственные предшественники эритробластов имеют ядра. Терминальное созревание эритробластов в функциональные РБК требует сложного процесса ремоделирования, который заканчивается экструзией ядра и образованием энуклеированного РБК. Перепрограммирование клеток часто нарушает процесс энуклеации. Трансфузия in vitro генерируемых РБК или эритробластов не обеспечивает достаточной защиты от опухолевого образования.
Путь арилового углеводородного рецептора (AhR) (который, как было показано, участвует в содействии развитию раковых клеток) играет важную роль в нормальном развитии клеток крови. Активация AhR в человеческих кроветворных прогениторных клетках (HPs) приводит к беспрецедентному расширению HPS, мегакариоцитарных и эритроидных клеток. Смотрите также краткий обзор: The SH2B3 ген кодирует отрицательный регулятор цитокиновой сигнализации и естественно возникающие варианты потери функции в этом гене увеличивают количество РБК in vivo. Целенаправленное подавление SH2B3 в первичных гемопоэтических стволовых и прогениторных клетках человека повышало созревание и общий выход РБК, полученных in vitro. Кроме того, инактивация SH2B3 путем редактирования генома CRISPR / Cas9 в плюрипотентных стволовых клетках человека позволила увеличить экспансию эритроидных клеток при сохранении дифференцировки. (См. также Обзор.
Тромбоциты[править]
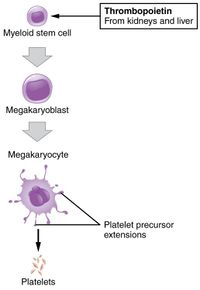
Тромбоциты помогают предотвратить кровотечение у тромбоцитопенических пациентов и пациентов с тромбоцитемией . Существенной проблемой для пациентов с многотрансфузией является рефрактерность к переливанию тромбоцитов. Таким образом, способность генерировать тромбоцитарные продукты ex vivo и тромбоцитарные продукты, лишенные антигенов HLA в свободных от сыворотки средах, будет иметь клиническую ценность. Механизм на основе РНК-интерференции, основанный на использовании лентивирусного вектора для экспрессии короткоцепочечных RNAi, нацеленных на β2-микроглобулиновые транскрипты в CD34-позитивных клетках. Сгенерированные тромбоциты продемонстрировали снижение антигенов HLA I класса на 85%. Эти тромбоциты, по-видимому, имеют нормальную функцию in vitro
Одна из клинически применимых стратегий получения функциональных тромбоцитов из ИПСК человека включает создание стабильных бессмертных мегакариоцитарных прогениторных клеточных линий (imMKCLs) посредством доксициклинзависимой сверхэкспрессии BMI1 и BCL-XL . Полученные имккл могут быть расширены в культуре в течение длительных периодов (4-5 месяцев), даже после криоконсервации . Остановка сверхэкспрессии (путем удаления доксициклина из среды) c-MYC, BMI1 и BCL-XL при выращивании imMKCLs приводила к продукции CD42b+ тромбоциты с функциональностью, сопоставимой с таковой нативных тромбоцитов на основе ряда анализов in vitro и in vivo. Thomas et al., опишите стратегию прямого программирования, основанную на одновременном экзогенном выражении 3 транскрипционных факторов: GATA1 , FLI1 и TAL1 . Передние запрограммированные мегакариоциты пролиферируют и дифференцируются в культуре в течение нескольких месяцев с чистотой мегакариоцитов более 90%, достигая до 2x10 5 зрелые мегакариоциты на вход hPSC. Функциональные тромбоциты генерируются на протяжении всей культуры, что позволяет в перспективе собрать несколько единиц переливания из всего лишь одного миллиона исходных hpcc. Смотрите также Обзор
Иммунные клетки[править]
Специализированный тип лейкоцитов, известный как цитотоксические Т -лимфоциты (CTLs), вырабатываются иммунной системой и способны распознавать специфические маркеры на поверхности различных инфекционных или опухолевых клеток, заставляя их запускать атаку, чтобы убить вредные клетки. Таким образом, иммунотерапия функциональными антиген-специфическими Т-клетками имеет потенциал в качестве терапевтической стратегии для борьбы со многими видами рака и вирусными инфекциями. однако, источники клетки ограничены, потому что они произведены в малом количестве естественно и имеют короткую продолжительность жизни.
Потенциально эффективный подход для генерирования антиген-специфичных CTLs заключается в том, чтобы вернуть зрелые иммунные Т-клетки в IPSC, которые обладают неопределенной пролиферативной способностью in vitro, и после их размножения уговорить их повторно дифференцироваться обратно в Т-клетки.
Другой метод объединяет технологии iPSC и химерного рецептора антигена (CAR) для получения человеческих Т-клеток , нацеленных на CD19 , антиген, экспрессируемый злокачественными в-клетками, в культуре тканей. этот подход генерирования терапевтических Т-клеток человека может быть полезен для Иммунотерапии рака и других медицинских применений.
Инвариантные естественные киллерные Т-клетки (инкт) обладают большим клиническим потенциалом в качестве адъювантов для Иммунотерапии рака. инкт-клетки действуют как врожденные Т-лимфоциты и служат мостиком между врожденной и приобретенной иммунной системами . Они усиливают противоопухолевый ответ, производя интерферон-гамма (ИФН-γ).[252] был предложен подход сбора, перепрограммирования/дедифференцировки, повторной дифференцировки и инъекции для соответствующего лечения опухоли.
Дендритные клетки (ДК) специализированы для того чтобы контролировать реакции Т-клетки. ДК с соответствующими генетическими модификациями могут сохраняться достаточно долго для стимуляции антиген-специфического CTL и после этого быть полностью устранены. Источником вакцинотерапии могут служить DC-подобные антигенпрезентирующие клетки, полученные из индуцированных человеком плюрипотентных стволовых клеток.
CCAAT / enhancer связывая протеин-α (C/EBPa) наводит transdifferentiation клеток B в макрофаги на высоких эффективностях и увеличивает перепрограммировать в клетки iPS когда co-выраженный с факторами Oct4, Sox2, Klf4 и Myc транскрипции.[256] с 100-кратным увеличением эффективности перепрограммирования клеток iPS, включающей 95% населения. Furthermore, C/EBPa может преобразовать выбранные людские линии клетки лимфомы и лейкемии клетки B в макрофаг-подобные клетки на высоких эффективностях, повреждая емкость клеток опухоль-формируя.
Омоложение клеток тимического эпителия[править]
Тимус-это первый орган, который разрушается с возрастом людей. Это сокращение является одной из основных причин того, что иммунная система с возрастом становится менее эффективной. Снижение экспрессии фактора транскрипции ТИМИЧЕСКИХ эпителиоцитов FOXN1 было вовлечено в качестве компонента механизма, регулирующего возрастную инволюцию.
Клэр Блэкберн и ее коллеги показали , что установленная возрастная инволюция тимуса может быть обращена вспять принудительной регуляцией только одного транскрипционного фактора-FOXN1 в клетках тимического эпителия с целью содействия омоложению, пролиферации и дифференцировке этих клеток в полнофункциональный тимический эпителий.[261] Это омоложение и повышенная пролиферация сопровождались повышением регуляции генов, которые способствуют прогрессированию клеточного цикла (циклин D1, ΔN p63, FgfR2IIIb ) и которые необходимы в клетках тимического эпителия для содействия конкретным аспектам развития Т-клеток ( Dll4, Kitl , Ccl25, Cxcl12, Cd40, Cd80, Ctsl, Pax1).
Мезенхимальные стволовые клетки[править]
Индукция[править]
мезенхимальные стволовые / стромальные клетки (мск) исследуются для применения в кардиальной, почечной, нервной, суставной и костной репарации, а также при воспалительных состояниях и гемопоэтической котрансплантации. это связано с их иммуносупрессивными свойствами и способностью дифференцироваться в широкий спектр мезенхимально-родовых тканей. Мск обычно собирают из взрослого костного мозга или жира, но они требуют болезненных инвазивных процедур и являются низкочастотными источниками, составляя всего 0,001-0,01% клеток костного мозга и 0,05% в аспиратах липосакции. Что касается аутологичного применения, в частности у пожилых людей, наиболее нуждающихся в репарации тканей, то количество и качество мск с возрастом снижаются.
IPSCs можно было получить путем омоложения клеток даже у долгожителей. поскольку IPSC могут быть получены без этических ограничений, а культура может быть расширена до бесконечности, они являются выгодным источником MSCs. обработка IPSC с SB-431542 водит к быстрому и равномерному поколению MSC от людского iPSCs. (SB-431542 является ингибитором активина / TGF - путей путем блокирования фосфорилирования ALK4, ALK5 и ALK7 рецепторы.) Эти ИПС-мск могут не обладать способностью к тератомообразованию, демонстрировать нормальный стабильный кариотип в культуре и проявлять ростовые и дифференцировочные характеристики, которые близко напоминают таковые у первичных мск. Оно имеет потенциал для ин витро масштаба-вверх, включающ основанные на МСК терапии. мск, полученные из ИПСК, обладают способностью способствовать регенерации пародонта и являются перспективным источником легкодоступных стволовых клеток для использования в клиническом лечении пародонтита.
Лай и др., & Lu сообщают химический метод для того чтобы произвести MSC-подобные клетки (iMSCs), от людских первичных дермальных фиброцитов используя 6 химических Иов АБС битор (SP600125, SB202190, Go6983, Y-27632, PD0325901, и CHIR99021) С или без 3 факторов роста (преобразовывая фактора роста-β (TGF-β), основного фактора роста фиброцита (bFGF), и фактора лейкемии inhibitory (LIF)). Химический коктейль непосредственно преобразует человеческие фибробласты в имск с монослойной культурой через 6 дней, и коэффициент конверсии составил примерно 38%.
Помимо клеточной терапии in vivo, культуру мезенхимальных стволовых клеток человека можно использовать in vitro для массового производства экзосом, которые являются идеальными транспортными средствами для доставки лекарственных средств.
Дедифференцированные адипоциты[править]
Жировая ткань, благодаря своему обилию и относительно менее инвазивным методам сбора урожая, представляет собой источник мезенхимальных стволовых клеток (мск). К сожалению, липосакционные аспираты составляют всего 0,05% мск. однако, большое количество зрелых адипоцитов, которые в целом потеряли свои пролиферативные способности и поэтому обычно отбрасываются, могут быть легко выделены из суспензии жировых клеток и дедифференцированы в свободные от липидов фибробластоподобные клетки, называемые дедифференцированными жировыми клетками (DFAT). Клетки DFAT восстанавливают активную способность к пролиферации и экспрессируют мультипотентные способности. Сравненный с взрослыми стволовыми клетками, клетки ДФАТ показывают уникальные преимущества в обилии, изоляции и гомогенности. Под надлежащей индукционной культурой in vitro или надлежащей средой in vivo клетки DFAT могут демонстрировать адипогенные, остеогенные, хондрогенные и миогенные потенциалы. Они также могут проявлять периваскулярные характеристики и вызывать неоваскуляризацию.
Хондрогенные клетки[править]
Хрящ-это соединительная ткань, отвечающая за бесфрикционное движение сустава. Его дегенерация в конечном итоге приводит к полной потере функции суставов на поздних стадиях остеоартроза . Как аваскулярная и гипоцеллюлярная ткань, хрящевина имеет лимитированную емкость для собственн-ремонта. Хондроциты-это единственный тип клеток в хряще, в котором они окружены внеклеточным матриксом, который они выделяют и собирают.
Один из способов получения хряща заключается в том, чтобы индуцировать его из клеток iPS.[276] альтернативно, возможно преобразовать фибробласты сразу в наведенные хондрогенические клетки (iChon) без промежуточного этапа клетки iPS, путем вводить 3 перепрограммируя фактора (c-MYC, KLF4 и SOX9). клетки ихона человека экспрессировали маркерные гены для хондроцитов (коллаген II типа), но не фибробластов.
Имплантированные в дефекты, созданные в суставном хряще крыс, клетки ихона человека выживали, чтобы сформировать хрящевую ткань по крайней мере в течение четырех недель, без опухолей. Метод использует c-MYC, который, как полагают, играет важную роль в опухолевом генезе и использует ретровирус для введения перепрограммирующих факторов, исключая его из немодифицированного использования в терапии человека.
Источники ячеек для перепрограммирования[править]
Наиболее часто используемыми источниками для перепрограммирования являются клетки крови и фибробласты, полученные путем биопсии кожи ,но взятие клеток из мочи является менее инвазивным. последний метод не требует биопсии или взятия пробы крови. По состоянию на 2013 год полученные из мочи стволовые клетки были дифференцированы на эндотелиальные, остеогенные, хондрогенные, адипогенные, скелетные миогенные и нейрогенные линии без образования тератом. Поэтому их эпигенетическая память подходит для перепрограммирования в IP-клетки. Однако в моче появляется мало клеток, была достигнута лишь низкая эффективность конверсии, и риск бактериального загрязнения относительно высок.
Еще одним перспективным источником клеток для перепрограммирования являются мезенхимальные стволовые клетки, полученные из фолликулов человеческого волоса.
Происхождение соматических клеток, используемых для перепрограммирования, может влиять на эффективность перепрограммирования функциональные свойства полученных индуцированных стволовых клеток и способность образовывать опухоли.
ИПСК сохраняют эпигенетическую память о своей ткани происхождения, что влияет на их дифференцировочный потенциал. Эта эпигенетическая память не обязательно проявляет себя на стадии плюрипотентности – ИПСК, полученные из различных тканей, проявляют надлежащую морфологию, экспрессируют маркеры плюрипотентности и способны дифференцироваться в три эмбриональных слоя in vitro и in vivo. Однако эта эпигенетическая память может проявляться при повторной дифференцировке в определенные типы клеток, которые требуют наличия специфических локусов, несущих остаточные эпигенетические метки.
Смотрите также[править]
- Трансдифференциация
- Примеры трансдифференциации in vitro по родословной-поучительный подход
- Примеры трансдифференцировки in vitro методом начального эпигенетического активационного фазового подхода
- Примеры трансдифференциации in vivo по линии происхождения-поучительный подход
- Ниши стволовых клеток, индуцированные травмой
- Транскрипционный фактор
- Фактор роста
- Пионерские факторы
- Клеточная дифференцировка
- CAF-1
Читать[править]
- pymolwiki.org/ программа молекулярной визуализации PyMOL.