Сера
Эта статья посвящена химическому элементу. Для других целей см. раздел Сера (неоднозначность).
Сера (в британском английском: sulphur) - это химический элемент с символом S и атомным номером 16. Она обильна, многовалентна и неметаллична. В нормальных условияхатомы серы образуют циклические восьмиатомные молекулы с химической формулой S8. Элементарная сера представляет собой ярко-желтое кристаллическое твердое вещество при комнатной температуре.
Сера-десятый по массе элемент во Вселенной и пятый по распространенности на земле. Хотя иногда встречается в чистом, природном виде, сера на Земле обычно встречается в виде сульфидных и сульфатных минералов. Будучи в изобилии в естественной форме, сера была известна в древние времена, упоминается для ее использования в Древней Индии, Древней Греции, Китаеи Египте. Исторически и в литературе серу также называют серой, что означает "горящий камень".[5] сегодня почти вся элементарная сера производится как побочный продукт удаления серосодержащих загрязнений из природного газа и нефти Наибольшим коммерческим использованием этого элемента является производство серной кислоты для сульфатных и фосфорных удобрений, а также другие химические процессы. Элемент сера используется в спичках, инсектицидахи фунгицидах. Многие соединения серы имеют неприятный запах, а запахи одорированного природного газа, запах скунса, грейпфрута и чеснока обусловлены сероорганическими соединениями. Сероводород придает характерный запах тухлым яйцам и другим биологическим процессам.
Сера является необходимым элементом для всей жизни, но почти всегда в виде сероорганических соединений или сульфидов металлов. Три аминокислоты (цистеин, цистини метионин) и два витамина (биотин и тиамин) являются сероорганическими соединениями. Многие кофакторы также содержат серу, включая глутатион, тиоредоксини железосернистые белки. Дисульфиды, S–S связи, придают механическую прочность и нерастворимость белковому кератину, содержащемуся во внешней коже, волосах и перьях. Сера является одним из основных химических элементов необходимых для биохимического функционирования и является элементарным макроэлементом для всех живых организмов.

Характеристики[править]
Физические свойства[править]
Сера образует несколько многоатомных молекул. Наиболее известным аллотропом является октасульфур, Цикло-S8. На момент группа из Цикло-с8 Д4Д и ее дипольный момент равен 0 д. Octasulfur мягкая, ярко-желтое твердое тело, которая не имеет запаха, но нечистые образцы имеют специфический запах похож на матчи. он плавится при 115.21 °с (239.38 °F) и кипит при 444.6 °с (832.3 °F) и возгоняет легко. при температуре 95,2 °C (203,4 °F), ниже температуры плавления, циклооктасульфур переходит из α-октасульфура в β -полиморф. Структура S8 кольцо практически не изменяется при этом изменении фазы, что влияет на межмолекулярные взаимодействия. Между температурами плавления и кипения октасульфур снова меняет свой аллотроп, превращаясь из β-октасульфура в γ-серу, снова сопровождаясь более низкой плотностью, но повышенной вязкостью из-за образования полимеров. При более высоких температурах вязкость уменьшается по мере того, как происходит деполимеризация. Расплавленная сера принимает темно-красный цвет выше 200 °C (392 °F). Плотность серы составляет около 2 г/см3, в зависимости от аллотропа; все стабильные аллотропы являются превосходными электрическими изоляторами.
Химические свойства[править]
Сера горит синим пламенем с образованием сернистогогаза , который имеет удушливый и раздражающий запах. Сера нерастворима в воде, но растворима в сероуглероде и, в меньшей степени, в других неполярных органических растворителях, таких как бензол и толуол. Первая и вторая энергии ионизации серы составляют 999,6 и 2252 кДж / моль соответственно. Несмотря на такие цифры, состояние окисления +2 встречается редко, причем +4 и +6 встречаются чаще. Четвертый и шестой энергии ионизации являются 4556 и 8495.8 кДж/моль, величина фигур, вызванных переносом электрона между орбиталями; эти состояния только конюшня с сильными окислителями как фтор, кислороди хлор.[править] сера реагирует почти со всеми другими элементами, за исключением инертных газов, даже с заведомо инертен металла иридия (уступая иридий дисульфид). Некоторые из этих реакций требуют повышенных температур.
Изотопы[править]
Основная статья: Изотопы серы
Сера состоит из 23 известных изотопов, четыре из которых стабильны: 32С (94.99%±0.26%), 33с (0.75%±0.02%), 34с (4.25%±0.24%), а 36с (0.01%±0.01%). Другие, чем 35С, с периодом полураспада 87 дней и образуются в космических лучей скалывания от 40АР, в радиоактивных изотопов серы имеют периоды полураспада менее 3 часов.
При осаждении сульфидных минералов изотопное равновесие между твердыми и жидкими частицами может приводить к небольшим различиям в значениях δ34sкогенетических минералов. Различия между минералами могут быть использованы для оценки температуры равновесия. Значения δ13С и δ34С сосуществующих карбонатных минералов и сульфидов могут быть использованы для определения рН и кислородной фугитивности рудоносного флюида при рудообразовании.
В большинстве лесных экосистем сульфат извлекается главным образом из атмосферы; выветривание рудных минералов и эвапоритов вносит некоторый вклад серы. Сера с характерным изотопным составом была использована для идентификации источников загрязнения, а обогащенная сера была добавлена в качестве индикатора в гидрологических исследованиях. Различия в естественном содержании могут быть использованы в системах, где существует достаточная вариабельность 34С компонентов экосистемы. Было обнаружено, что скалистые горные озера, в которых предположительно преобладают атмосферные источники сульфатов, имеют характерные 34Значения S из озер, как полагают, преобладают над водосборными источниками сульфата.
Естественное возникновение[править]
С создается внутри массивных звезд, на глубине, где температура превышает 2,5×109 к, путем слияния одного ядра кремния плюс одно ядро гелия.Поскольку эта ядерная реакция является частью Альфа - процесса, который производит элементы в изобилии, сера является 10-м наиболее распространенным элементом во Вселенной.
Сера, обычно в виде сульфида, присутствует во многих типах метеоритов. Обычные хондриты содержат в среднем 2,1% серы, а углеродистые хондриты могут содержать до 6,6%. Обычно он присутствует в виде троилита (FeS), но есть исключения, с углеродистыми хондритами, содержащими свободную серу, сульфаты и другие соединения серы.[14] Отличительные цвета вулканической луны Юпитера Ио приписываются различным формам расплавленной, твердой и газообразной серы.]
Это пятый по массе наиболее распространенный элемент на Земле. Элементарная сера может быть найдена вблизи горячих источников и вулканических регионов во многих частях мира, особенно вдоль тихоокеанского Огненного кольца; такие вулканические месторождения в настоящее время добываются в Индонезии, Чили и Японии. Эти месторождения являются поликристаллическими, с самым большим документированным монокристаллом размером 22×16×11 см.[16] исторически Сицилия была основным источником серы во время промышленной революции. на морском дне были обнаружены озера расплавленной серы диаметром до ~200 м, связанные с подводными вулканами, на глубинах, где температура кипения воды выше, чем температура плавления серы.
Самородная сера синтезируется анаэробными бактериями, действующими на сульфатные минералы, такие как гипс в соляных куполах. значительные залежи в соляных куполах встречаются вдоль побережья Мексиканского залива, а также в эвапоритах в Восточной Европе и Западной Азии. Самородная сера может быть получена только в результате геологических процессов. Ископаемые залежи серы из соляных куполов когда-то были основой для промышленного производства в США, России, Туркменистане и Украине. В настоящее время промышленная добыча все еще ведется на шахте Осиек в Польше. Такие источники сейчас имеют второстепенное коммерческое значение, и большинство из них больше не работают.
Распространенных в природе соединений серы включают сульфидных минералов, таких как пирит (сульфид железа), киноварь (сульфид ртути), галенит (сульфид свинца), сфалерит (сульфид цинка) и сурьмы (сульфид сурьмы); и сульфаты, такие как гипс (сульфат кальция), алунит (калия алюминия сульфат) и барит (сульфат бария). На Земле, как и на спутнике Юпитера Ио, элементарная сера встречается естественным образом в вулканических выбросах, включая выбросы из гидротермальныхисточников .
Соединения[править]
Смотрите также: категория:Соединения серы
Общие степени окисления серы колеблются от -2 до +6. Сера образует стабильные соединения со всеми элементами, кроме благородных газов.
Аллотропы[править]
Основная статья: Аллотропы серы
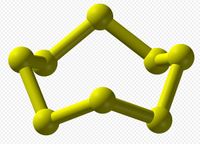
Сера образует более 30 твердых аллотропов, больше, чем любой другой элемент. помимо S8известно несколько других колец. удаление одного атома из короны дает S7, который более темно-желтый, чем S8. ВЭЖХ-анализ "элементарной серы" показывает равновесную смесь в основном S8, но с S7 и небольшими количествами S6. были получены более крупные кольца, включая S12 и S18.
Аморфная или "пластичная" сера образуется при быстром охлаждении расплавленной серы—например, при заливке ее в холодную воду. Рентгеноструктурные исследования показывают, что аморфная форма может иметь спиральную структуру с восемью атомами на оборот. Длинные спиральные полимерные молекулы делают коричневатое вещество эластичным, и в массе эта форма имеет ощущение сырой резины. Эта форма метастабильна при комнатной температуре и постепенно возвращается к кристаллическому молекулярному аллотропу, который больше не является эластичным. Этот процесс происходит в течение нескольких часов или дней, но может быть быстро катализирован.
Поликатионы и полианионы[править]
Поликатионы серы, S82+, S42+ и S162+ образуются при взаимодействии серы с мягкими окислителями в сильнокислом растворе. Окрашенные растворы, полученные путем растворения серы в олеуме, были впервые сообщены еще в 1804 году C. F. Bucholz, но причина цвета и структуры вовлеченных поликатионов была определена только в конце 1960-х годов. S82+ темно-синий, S42+ желтый и S162+ Красный.
Радикал анион S3-дает синий цвет минерала лазурит. Две параллельные Серные цепи, выращенные внутри одностенной углеродной нанотрубки (УНТ, а). зигзагообразные (Б) и Прямые (в) S-цепи внутри двухстенных УНТ
Сульфиды[править]
Обработка серы водородом дает сероводород. При растворении в воде сероводород слабо кислый:
H2S ⇌ HS− + H+
Газообразный сероводород и анион гидросульфида чрезвычайно токсичны для млекопитающих из-за их ингибирования кислородсодержащей способности гемоглобина и некоторых цитохромов аналогично цианиду и азиду (см. ниже, в разделе "Меры предосторожности").
Восстановление элементарной серы дает полисульфиды, которые состоят из цепочек атомов серы, оканчивающихся S− центрами:
2 Na + S8 → Na2S8
Эта реакция подчеркивает отличительное свойство серы: ее способность катенироваться (связываться с собой путем образования цепей). Протонирование этих полисульфидных анионов приводит к образованию полисульфанов, H2Sx, где x= 2, 3 и 4.в конечном счете восстановление серы приводит к образованию сульфидных солей:
16 Na + S8 → 8 Na2S
Взаимопревращение этих видов используется в натриево-серной батарее.
Оксиды, оксокислоты и оксоанионы[править]
Основные оксиды серы получают путем сжигания серы:
S + O2 → SO2 (диоксид серы) 2 SO2 + O2 → 2 SO3 (триоксид серы)
Известны многочисленные оксиды серы; богатые серой оксиды включают монооксид серы, монооксид дисульфура, диоксиды дисульфура и более высокие оксиды, содержащие пероксо-группы.
Сера образует оксокислоты серы, некоторые из которых не могут быть выделены и известны только через соли. Диоксид серы и сульфиты
(SO2−3)
относятся к нестабильной сернистой кислоте (H2SO3). Триоксид серы и сульфаты
(SO2−4)
связаны с серной кислотой (H2SO4). Серная кислота и SO3 соединяются, чтобы дать олеум, раствор пиросульфокислоты (H2S2O7) в серной кислоте.
Тиосульфатные соли
(S2o2−3),
иногда называемые "гипосульфитами", используемые в фотографической фиксации (hypo) и в качестве восстановителей, содержат серу в двух состояниях окисления. Дитионит натрия
(Na2S2O4),
содержит более сильно восстанавливающий анион дитионита
(S2O2−4).
Галогениды и оксигалогениды[править]
Некоторые галогениды серы важны для современной промышленности. Гексафторид серы-это плотный газ, используемый в качестве изоляционного газа в высоковольтных трансформаторах; он также является нереактивным и нетоксичным топливом для контейнеров под давлением. Тетрафторид серы-редко используемый органический реагент, который очень токсичен.[30] дихлорид серы и дихлорид дисульфура являются важными промышленными химическими веществами. Сульфурилхлорид и хлорсульфокислота являются производными серной кислоты; тионилхлорид (SOCl2) является распространенным реагентом в органическом синтезе.]
Пниктиды[править]
Важным соединением S–N является тетрасульфат тетранитрид клетки (S4N4). Нагревание этого соединения дает полимерный нитрид серы ((SN)x), который обладает металлическими свойствами, хотя и не содержит атомов металла. Тиоцианаты содержат SCN− группу. Окисление тиоцианата дает тиоцианоген(SCN)2 со связью NCS-SCN. сульфиды фосфора многочисленны, наиболее важными коммерчески являются клетки P4S10 и P4S3.
Сульфиды металлов[править]
Основная статья: Сульфидный минерал
Основными рудами меди, цинка, никеля, кобальта, молибдена и других металлов являются сульфиды. Эти материалы, как правило, представляют собой темные полупроводники, которые не так легко атакуются водой или даже многими кислотами. Они образуются, как геохимически, так и в лабораторных условиях, в результате реакции сероводорода с солями металлов. Минерал Галена (PbS) был первым продемонстрированным полупроводником и использовался в качестве выпрямителя сигнала в кошачьих усах ранних кристаллических радиоприемников. Сульфид железа , называемый пирит, так называемое "золото дурака", имеет формулу FeS2. обработка этих руд, как правило, путем обжига, является дорогостоящим и экологически опасным. Сера разъедает многие металлы через потускнение.
Органические соединения[править]
Основная статья: Сероорганические соединения
- Иллюстративные сероорганические соединения
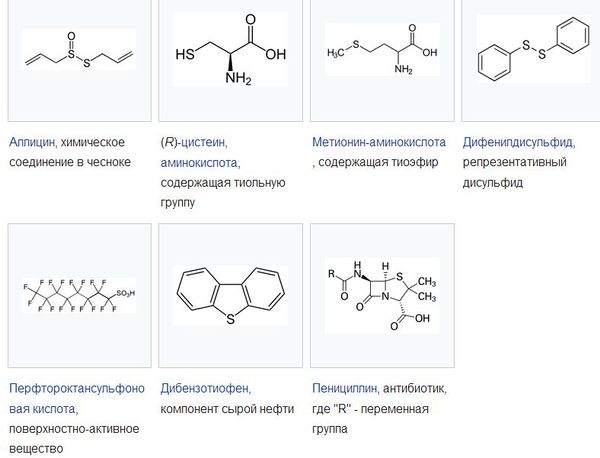
Некоторые из основных классов серосодержащих органических соединений включают следующие:[35]
- Тиолы или меркаптаны (так называемые потому, что они захватывают ртуть в качестве хелаторов) являются серными аналогами спиртов; обработка тиолов основанием дает тиолат-ионы.
- Тиоэфиры являются серными аналогами эфиров.
- Ионы сульфония имеют три группы, прикрепленные к катионному центру серы. Dimethylsulfoniopropionate (DMSP) одна такая смесь, важная в морском органическом цикле серы.
- Сульфоксиды и сульфоны - это тиоэфиры с одним и двумя атомами кислорода, присоединенными к атому серы, соответственно. Самый простой сульфоксид, диметилсульфоксид, является общим растворителем; общий сульфон-это сульфолан.
- Сульфокислоты используются во многих моющих средствах.
Соединения с множественными связями углерод-сера встречаются редко, исключение составляет сероуглерод, Летучая бесцветная жидкость, структурно похожая на углекислый газ. Он используется в качестве реагента для получения полимерной вискозы и многих сероорганических соединений. В отличие от монооксидауглерода , моносульфид углерода стабилен только как чрезвычайно разбавленный газ, находящийся между солнечными системами.
Сероорганические соединения отвечают за некоторые неприятные запахи разлагающихся органических веществ. Они широко известны как одорант в бытовом природном газе, запах чеснока и брызги скунса. Не все органические соединения серы неприятно пахнут при всех концентрациях: серосодержащий монотерпеноид (грейпфрутовый меркаптан) в малых концентрациях является характерным запахом грейпфрута, но имеет общий тиоловый запах при больших концентрациях. Сернистая горчица, мощное везикантноесредство, использовалась в Первую Мировую войну в качестве средства для выведения из строя.
Сера-Серные связи являются структурным компонентом, используемым для придания жесткости резине, подобно дисульфидным мостикам, которые придают жесткость белкам (см. биологию ниже). В наиболее распространенном типе промышленного "отверждения" или отверждения и упрочнения природного каучукаэлементарная сера нагревается вместе с каучуком до такой степени, что химические реакции образуют дисульфидные мостики между изопреновыми звеньями полимера. Этот процесс, запатентованный в 1843 году, сделал резину крупным промышленным продуктом, особенно в автомобильных шинах. Из-за высокой температуры и серы этот процесс был назван вулканизацией, в честь римского бога кузнечного дела. вулканизм.
История[править]
Античность[править]
Будучи в изобилии доступной в естественной форме, сера была известна еще в древние времена и упоминается в Торе (бытие). Английские переводы Библии обычно называют горящую серу "серой", что дает начало термину "огненно-Серные" проповеди, в которых слушателям напоминают об участи вечного проклятия, ожидающего неверующих и нераскаявшихся. Именно в этой части Библии подразумевается, что ад "пахнет серой" (вероятно, из-за его связи с вулканической активностью). Согласно папирусу Эберса, серная мазь использовалась в Древнем Египте для лечения зернистых век. Сера использовалась для окуривания в доклассической Греции; об этом упоминается в "Одиссее". Плиний Старший обсуждает серу в книге 35 своей Естественной Истории, говоря, что ее самый известный источник-остров Мелос. Он упоминает его использование для окуривания, медицины и отбеливания ткани.
Естественной формой серы, известный как shiliuhuang (石硫黄) был известен в Китае с 6 в. до н. э. и нашли в Ханьчжун. по 3-м веке, китайцы обнаружили, что сера может быть извлечен из пирита. китайские даосы были заинтересованы в Серуи по горючесть и реакционная способность некоторых металлов, однако его ранние практического применения были найдены в традиционной китайской медицине. В династии Сун военный трактат 1044 объявление описаны различные формулы для китайских черный порошок, который является смесью нитрата калия (kno по 3), древесного угляи серы. Он остается ингредиентом черный порох.

Индийские алхимики, практикующие "науку о химических веществах" (санскритская расашастра), много писали об использовании серы в алхимических операциях с ртутью, начиная с восьмого века нашей эры. в традиции расашастры серу называют "вонючей" (санскрит гандхака ,नन्कक).
Ранние европейские алхимики дали сере уникальный алхимический символ- треугольник на вершине креста (🜍). Астрологический символ для 2 Паллады, алмаз в верхней части креста (⚴), является вариантом для серы. В традиционном лечении кожи элементарная сера использовалась (главным образом в кремах) для облегчения таких состояний , как чесотка, стригущий лишай, псориаз, экземаи акне. Механизм действия неизвестен—хотя элементарная сера действительно медленно окисляется до сернистой кислоты, которая (благодаря действию сульфита) является мягким восстановителем и антибактериальным агентом.
Современное время[править]
Сера появляется в колонке фиксированной (некислой) щелочи в химической таблице 1718 года. Антуан Лавуазье использовал серу в экспериментах по сжиганию, написав некоторые из них в 1777 году.
Месторождения серы на Сицилии были доминирующим источником на протяжении более чем столетия. К концу XVIII века около 2000 тонн серы в год импортировалось в Марсель, Франция, для производства серной кислоты для использования в процессе Леблана. В индустриальной Британии, с отменой тарифов на соль в 1824 году, спрос на серу из Сицилии резко вырос. Усиление британского контроля и эксплуатации добычи, переработки и транспортировки серы в сочетании с неспособностью этого прибыльного экспорта трансформировать отсталую и обнищавшую экономику Сицилии привело к Серный кризис 1840года , когда король Фердинанд II передал монополию на производство серы французской фирме, нарушив ранее заключенное в 1816 году торговое соглашение с Великобританией. Мирное решение в конечном итоге было согласовано Францией.
В 1867 году элементарная сера была обнаружена в подземных месторождениях в Луизиане и Техасе. Для извлечения этого ресурса был разработан весьма успешный процесс Фраша.
В конце 18 века производители мебели использовали расплавленную серу для изготовления декоративных инкрустаций в своем ремесле. Из-за двуокиси серы, образующейся в процессе плавления серы, ремесло серных инкрустаций вскоре было оставлено. Расплавленная сера иногда все еще используется для установки стальных болтов в просверленные бетонные отверстия, где требуется высокая ударопрочность для точек крепления напольного оборудования. Чистая порошкообразная сера использовалась в качестве лекарственного тонизирующего и слабительного средства. С появлением контактного процесса, большинство серы сегодня используется для производства серной кислоты для широкого спектра применений, в частности удобрений.
Орфография и этимология[править]
Сера происходит от латинского слова sulpur, которое было Эллинизировано до серы в ошибочном убеждении, что латинское слово произошло от греческого. Это написание позже было переосмыслено как представляющее звук /f/ и привело к написаниюSulphur , которое появляется на латыни ближе к концу классического периода. Истинное греческое слово для обозначения серы, θεοον, является источником международного химического префикса thio-. В 12-м веке англо-французский, это был sulfre. В 14 веке ошибочно эллинизированная латынь-ph - была восстановлена в среднеанглийском sulphre К 15 веку оба полных латинских варианта написания Sulphur и sulphur стали распространенными в английском языке. Параллельное написание f~ph продолжалось в Британии до 19-го века, когда слово было стандартизировано как sulphur. с другой стороны, сера была формой, выбранной в Соединенных Штатах, тогда как Канада использует и то, и другое. IUPAC принял орфографию сера в 1990 или 1971 году, в зависимости от цитируемого источника, как и номенклатурный комитет Королевского химического общества в 1992 году, восстановив орфографию сера в Великобритании. Оксфордские словари отмечают, что "в химии и других технических целях ... написание-f - теперь является стандартной формой для этого и связанных с ним слов как в британском, так и в американском контекстах, а также все чаще используется в общих контекстах".]
Производство[править]
Сера может быть найдена сама по себе и исторически обычно получалась в этой форме; пирит также был источником серы. в вулканических районах Сицилиив древние времена он был найден на поверхности земли, и "Сицилийский процесс" было использовано: залежи серы складывались и укладывались в кирпичные печи, построенные на пологих склонах холмов, с воздушными пространствами между ними. Затем часть серы распылялась, распределялась по сложенной руде и воспламенялась, заставляя свободную серу плавиться вниз по холмам. В конце концов поверхностные отложения истощились, и шахтеры вырыли жилы, которые в конечном итоге усеяли Сицилийский ландшафт лабиринтами шахт. Добыча полезных ископаемых была немеханизированной и трудоемкой, с пикменами, освобождающими руду от породы, и шахтерскими мальчиками или карузи вынося корзины с рудой на поверхность, часто через милю или больше туннелей. Как только руда оказывалась на поверхности, ее восстанавливали и извлекали в плавильных печах. Условия в сицилийских серных шахтах были ужасающими, что побудило Букера т. Вашингтона написать: "я не готов прямо сейчас сказать, до какой степени я верю в физический ад в следующем мире, но Серные шахты на Сицилии-это почти самое близкое к аду, что я ожидаю увидеть в этой жизни"
Элементарная сера была извлечена из соляных куполов (в которых она иногда встречается почти в чистом виде) до конца 20-го века. Сера теперь производится как побочный продукт других промышленных процессов, таких как нефтепереработка, в которой сера нежелательна. Как минерал, самородная сера под соляными куполами считается ископаемым минеральным ресурсом, получаемым в результате действия анаэробных бактерий на сульфатные отложения. Он был удален из таких соляных куполов шахт главным образом с помощью процессаФраша. В этом методе перегретая вода закачивалась в нативное месторождение серы, чтобы расплавить серу, а затем сжатый воздух возвращал 99,5% чистого расплавленного продукта на поверхность. На протяжении всего 20-го века эта процедура производила элементарную серу, которая не требовала дальнейшей очистки. Из-за ограниченного количества таких месторождений серы и высокой стоимости их разработки, этот процесс для добычи серы не был использован в значительной степени нигде в мире с 2002 года.
Сегодня сера производится из нефти, природного газаи связанных с ними ископаемых ресурсов, из которых она получается в основном в виде сероводорода. Сероорганические соединения, нежелательные примеси в нефти, могут быть модернизированы путем подвергания их гидродесульфурации, которая расщепляет связи C–S:
R-S-R + 2 H2 → 2 RH + H2S
Полученный в результате этого процесса сероводород, а также как он происходит в природном газе, превращается в элементарную серу в процессе Клауса. Этот процесс влечет за собой окисление некоторого количества сероводорода до диоксида серы, а затем компропорционирование этих двух веществ:
3 O2 + 2 H2S → 2 SO2 + 2 H2O ИТАК, 2 + 2 H2S → 3 S + 2 H2O
Из-за высокого содержания серы в нефтяных песках Атабаски, запасы элементарной серы от этого процесса существуют по всей Альберте, Канада. еще один способ хранения серы в качестве вяжущего для бетона, полученный продукт, обладающий многими полезными свойствами (см. сера б). сера по-прежнему добывается из поверхностных отложениях в более бедные страны с вулканами, таких как Индонезия, и рабочие условия не улучшились с тех пор, как Букер т. Вашингтон дней.
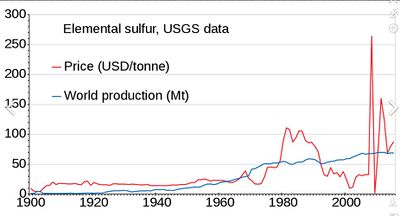
Мировое производство серы в 2011 году составило 69 млн тонн, причем более 15 стран внесли более 1 млн тонн каждая. Странами, производящими более 5 млн тонн, являются Китай (9,6), США (8,8), Канада (7,1) и Россия (7,1). производство медленно росло с 1900 по 2010 год; цена была нестабильной в 1980-х и около 2010 года.]
Приложения[править]
Серная кислота[править]
Элементарная сера используется в основном в качестве предшественника других химических веществ. Приблизительно 85% (1989) превращается в серную кислоту (H2SO4):
2 S + 3 O2 + 2 H2O → 2 H2SO4
В 2010 году Соединенные Штаты произвели больше серной кислоты, чем любой другой неорганический промышленный химикат. Основное применение кислоты заключается в добыче фосфатных руд для производства удобрений. Другие области применения серной кислоты включают нефтепереработку, очистку сточных вод и добычу полезных ископаемых.
Другая важная химия серы[править]
Сера непосредственно реагирует с метаном с образованием сероуглерода, который используется для производства целлофана и вискозы.[21] одно из применений элементарной серы заключается в вулканизации резины, где полисульфидные цепи сшивают органические полимеры. Большое количество сульфитов используется для отбеливания бумаги и консервирования сухофруктов. Многие поверхностно-активные вещества и детергенты (например, лаурилсульфат натрия) являются производными сульфатов. Сульфат кальция, гипс (CaSO4·2H2o) добывается в масштабе 100 миллионов тонн ежегодно для использования в портландцементе и удобрениях.
Когда фотография на основе серебра была широко распространена, тиосульфат натрия и аммония широко использовались в качестве "фиксирующих агентов". Сера входит в состав пороха ("черного пороха").
Удобрение[править]
Сера все чаще используется в качестве компонента удобрений. Наиболее важной формой серы для удобрения является минеральный сульфат кальция. Элементарная сера гидрофобна (не растворима в воде) и не может быть использована непосредственно растениями. Со временем почвенные бактерии могут превращать его в растворимые производные, которые затем могут быть использованы растениями. Сера улучшает эффективность других необходимых питательных веществ растений, в частности азота и фосфора. Биологически произведенные частицы серы естественно гидрофильны из-за биополимерного покрытия и легче рассеиваются по земле в виде брызг разбавленной суспензии, что приводит к более быстрому поглощению.
Ботаническая потребность в сере равна или превышает потребность в фосфоре. Это незаменимое питательное вещество для роста растений, образования корневых клубеньков бобовых культур, а также иммунитета и защитных систем. Дефицит серы получил широкое распространение во многих странах Европы. поскольку атмосферное поступление серы продолжает уменьшаться, дефицит ввода/вывода серы, вероятно, увеличится, если не будут использоваться Серные удобрения. Атмосферные поступления серы уменьшаются из-за действий, предпринятых для ограничения кислотных дождей.
Мелкодисперсные химические вещества[править]
Сероорганические соединения используются в фармацевтике, красителяхи агрохимикатах. Многие лекарственные препараты содержат серу; ранние примеры-антибактериальные сульфаниламиды, известные как сульфаниламидные препараты. Сера входит в состав многих защитных молекул бактерий. Большинство β-лактамных антибиотиков, включая пенициллины, цефалоспорины и монолактамы, содержат серу.]
Сульфат магния, известный как соли Эпсома, когда он находится в гидратированной кристаллической форме , может использоваться в качестве слабительного, добавки для ванн , эксфолианта, добавки магния для растений или (когда он находится в обезвоженной форме) в качестве осушителя.
Фунгицид и пестицид[править]
Элементарная сера - один из древнейших фунгицидов и пестицидов. "Пылящая сера", элементарная сера в порошкообразной форме, является распространенным фунгицидом для винограда, клубники, многих овощей и ряда других культур. Он обладает хорошей эффективностью против широкого спектра заболеваний мучнистой росой, а также черной пятнистостью. В органическом производстве сера является самым важным фунгицидом. Это единственный фунгицид используемый в органически выращенном производстве яблок против основного заболевания яблочной парши в более холодных условиях. Биосульфур (биологически полученная элементарная сера с гидрофильными характеристиками) также может быть использован для этих целей.
Стандартная рецептура пыления серой наносится на посевы с помощью сернистой пыльницы или с пылеулавливающей плоскости. Смачиваемая сера-это коммерческое название пылевидной серы, приготовленной с дополнительными ингредиентами, чтобы сделать ее смешиваемой с водой. Он имеет аналогичное применение и используется в качестве фунгицида против плесени и других проблем, связанных с плесенью растений и почвы.
Порошок элементарной серы используется в качестве "органического" (то есть "зеленого") инсектицида (фактически акарицида) против клещей и клещей. Распространенным методом нанесения является посыпание одежды или конечностей порошком серы.
Разбавленный раствор известковой серы (полученный путем соединения гидроксида кальция с элементарной серой в воде) используется в качестве погружения для домашних животных для уничтожения стригущего лишая (грибка), чесоткии других дерматозов и паразитов.
Серные свечи из почти чистой серы сжигались для окуривания строений и винных бочек, но теперь считаются слишком токсичными для жилых помещений.
Бактерицид в виноделии и консервации пищевых продуктов[править]
Небольшое количество сернистого газа, добавляемого (или эквивалентного добавлению метабисульфита калия) к ферментированному вину для получения следов сернистой кислоты (образующейсяпри взаимодействии SO2 с водой) и ее сульфитных солей в смеси, было названо "самым мощным средством в виноделии". после стадии дрожжевого брожения в виноделиисульфиты поглощают кислород и ингибируют аэробные процессы. бактериальный рост, который в противном случае превратил бы этанол в уксусную кислоту, скисающую вино. Без этой стадии консервирования обычно требуется неопределенное охлаждение продукта перед употреблением. Подобные методы восходят к глубокой древности, но современные исторические упоминания об этой практике относятся к пятнадцатому веку. Эта практика используется как крупными промышленными производителями вина, так и мелкими производителями органического вина.
Диоксид серы и различные сульфиты были использованы для их антиоксидантных антибактериальных консервирующих свойств во многих других частях пищевой промышленности. Эта практика сократилась после сообщений о аллергической реакции некоторых людей на сульфиты в пищевых продуктах.
Фармацевтические препараты[править]
Основная статья: Сера (аптека)
Сера (в частности ,октасульфур,S8) используется в фармацевтических препаратах для кожи для лечения акне и других состояний. Он действует как кератолитическое средство, а также убивает бактерии, грибы, чесоточные клещи и других паразитов.Осажденная сера и коллоидная сера используются в виде лосьонов, кремов , порошков, мыла и добавок для ванн для лечения вульгарных угрей, розовых угрейи себорейного дерматита.]
Общие побочные эффекты включают раздражение кожи в месте нанесения, такое как сухость, жжение, зуд и шелушение.
Мебель[править]
Основная статья: Серная инкрустация
Серу можно использовать для создания декоративных инкрустаций в деревянной мебели. После того, как рисунок был вырезан в древесине, расплавленная сера заливается, а затем соскабливается, чтобы она была заподлицо. Серные инкрустации были особенно популярны в конце 18-го и начале 19-го веков, особенно среди пенсильванских немецких краснодеревщиков. Эта практика вскоре прекратилась, поскольку были заменены менее токсичные и легковоспламеняющиеся вещества. Однако некоторые современные мастера время от времени возрождали эту технику при создании реплик изделий.
Биологическая роль[править]
Белковые и органические кофакторы[править]
Сера является важным компонентом всех живых клеток. Это либо седьмой, либо восьмой наиболее распространенный элемент в человеческом организме по весу , примерно равный по изобилию калиюи немного превышающий натрий и хлор. В 70 кг (150 фунтов) человеческого тела содержится около 140 граммов серы.
В растениях и животныхаминокислоты цистеин и метионин содержат большую часть серы, и этот элемент присутствует во всех полипептидах, белкахи ферментах , которые содержат эти аминокислоты. В организме человека метионин является незаменимой аминокислотой, которую необходимо принимать внутрь. Однако, за исключением витаминов биотина и тиамина, цистеин и все серосодержащие соединения в организме человека могут быть синтезированы из метионина. Фермент сульфитоксидаза необходим для метаболизма метионина и цистеина у человека и животных.
Дисульфидные связи (S-S-связи) между остатками цистеина в пептидных цепях очень важны для сборки и структуры белка. Эти ковалентные связи между пептидными цепями придают дополнительную прочность и жесткость.Например, высокая прочность перьев и волос частично объясняется высоким содержанием S-S связей с цистеином и серой. Яйца с высоким содержанием серы питают образование перьев у цыплят, а характерный запах гниющих яиц обусловлен сероводородом Высокое содержание дисульфидных связей в волосах и перьях способствует их неперевариваемости и характерному неприятному запаху при сжигании.
Гомоцистеин и таурин-это другие серосодержащие кислоты, сходные по структуре , но не кодируемые ДНКи не входящие в состав первичной структуры белков. Многие важные клеточные ферменты, с помощью простетическими группами заканчивая -Ш фрагментами для обработки реакций с участием ацил-содержащих веществ: два типичных примера из основных метаболизма коэнзима А и альфа-липоевая кислота. два из 13 классических витаминов, биотини тиамин, содержащих серу, при этом последний из них назван его содержания серы.
Во внутриклеточной химии сера действует как носитель восстановительного водорода и его электронов для клеточного восстановления окисления. Восстановленный глутатион, серосодержащий трипептид, является восстановителем благодаря своей сульфгидрильной (-SH) части, полученной из цистеина. Тиоредоксины, класс небольших белков, необходимых для всей известной жизни, используют соседние пары восстановленных цистеинов для работы в качестве общих белковых восстановителей с аналогичным эффектом.
Метаногенез, путь к большей части мирового метана, представляет собой многоступенчатую биохимическую трансформацию углекислогогаза . Для этого преобразования требуется несколько сероорганических кофакторов. Они включают кофермент м, CH3SCH2CH2SO3−, непосредственный предшественник метана.
Металлопротеины и неорганические кофакторы[править]
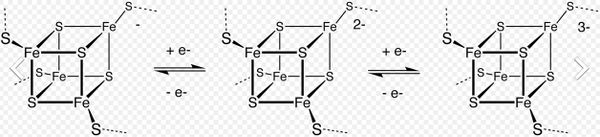
Металлопротеины, в которых активным участком является комплекс переходных металлов, связанный с атомами серы, являются важнейшими компонентами ферментов, участвующих в процессах переноса электронов. Примеры включают голубые медные белки и редуктазу закиси азота. Функция этих ферментов зависит от того, что Ион переходного металла может подвергаться окислительно-восстановительным реакциям.Другие примеры включают железосернистые кластеры, а также множество белков меди, никеля и железа. Наиболее распространенными являются ферродоксины, которые служат электронными челноками в клетках. В бактериях важную роль играет нитрогеназа. ферменты содержат Fe–Mo-s кластер и являются катализатором, который выполняет важную функцию фиксации азота, превращая атмосферный азот в аммиак, который может быть использован микроорганизмами и растениями для получения белков, ДНК, РНК, алкалоидов и других органических соединений азота, необходимых для жизни
Метаболизм серы и цикл серы[править]
Основные статьи: Метаболизм серы и Цикл серы
Серный цикл был первым из обнаруженных биогеохимических циклов. В 1880-х годах, изучая Beggiatoa (бактерию, живущую в богатой серой среде), Сергей Виноградский обнаружил, что она окисляет сероводород (H2s) в качестве источника энергии, образуя внутриклеточные капли серы. Виноградский называл эту форму обмена веществ иноргоксидацией (окислением неорганических соединений). Он продолжал изучать его вместе с Сельманом Ваксманом до 1950-х годов.
Окислители серы могут использовать в качестве источников энергии восстановленные соединения серы, включая сероводород, элементарную серу, сульфит, тиосульфати различные политионаты (например, тетратионат). они зависят от таких ферментов, как оксигеназа серы и сульфитоксидаза для окисления серы до сульфата. Некоторые литотрофы могут даже использовать энергию, содержащуюся в соединениях серы, для производства сахаров-процесс, известный как хемосинтез. Некоторые бактерии и археи используют сероводород вместо воды в качестве донора электронов в процессе хемосинтеза, аналогичном фотосинтезу он производит сахара и использует кислород в качестве акцептора электронов. У фотосинтезирующих зеленых серных бактерий и пурпурные Серные бактерии и некоторые lithotrophs использовать элементного кислорода для проведения таких окисления сероводорода для производства элементарной серы (S0), степень окисления= 0. Примитивные бактерии, обитающие вокруг глубоководных жерлах вулканов окисляют сероводород таким образом с кислородом; в гигантских трубчатых червей - пример большой организм, который использует сероводорода (с помощью бактерий) в пищу, чтобы быть окислены.
Так называемые сульфатредуцирующие бактерии, напротив, "дышат сульфатом" вместо кислорода. В качестве источника энергии они используют органические соединения или молекулярный водород. Они используют серу в качестве акцептора электронов и восстанавливают различные окисленные соединения серы обратно в сульфид, часто в сероводород. Они могут расти на других частично окисленных сернистых соединениях (например, тиосульфатах, тионатах, полисульфидах, сульфитах). Сероводород, производимый этими бактериями, отвечает за некоторые запахи кишечных газов (flatus) и продуктов разложения.
Сера поглощается корнями растений из почвы в виде сульфата и транспортируется в виде фосфатного эфира. Сульфат восстанавливается до сульфида через сульфит, прежде чем он включается в цистеин и другие сероорганические соединения.
SO42 - → SO32− → H2S → цистеин → метионин
Меры предосторожности[править]
Элементарная сера не токсична, как и большинство растворимых сульфатных солей, таких как английская . Растворимые сульфатные соли плохо всасываются и действуют слабительно. При парентеральном введении они свободно фильтруются почками и выводятся с очень малой токсичностью в многограммовых количествах.
Когда сера горит в воздухе, она производит двуокись серы. В воде этот газ производит сернистую кислоту и сульфиты; сульфиты являются антиоксидантами, которые подавляют рост аэробных бактерий и полезной пищевой добавкой в небольших количествах. В высоких концентрациях эти кислоты вредят легким, глазамили другим тканям. В организмах без легких, таких как насекомые или растения, сульфит в высокой концентрации препятствует дыханию.
Триоксид серы (полученный катализом из диоксида серы) и серная кислота аналогично сильно кислы и агрессивны в присутствии воды. Серная кислота является сильным обезвоживающим агентом, который может удалять доступные молекулы воды и компоненты воды из сахара и органических тканей.
При сжигании угля и/или нефти промышленностью и электростанциями образуется диоксид серы (SO2), который вступает в реакцию с атмосферной водой и кислородом с образованием серной кислоты (H2SO4) и сернистой кислоты (H2SO3). Эти кислоты являются компонентами кислотных дождей, снижающих рН почвы и пресноводных водоемов, что иногда приводит к существенному ущербу окружающей среде и химическому выветриванию статуй и сооружений. Топливные стандарты все чаще требуют, чтобы производители топлива извлекали серу из ископаемых видов топлива для предотвращения образования кислотных дождей. Эта добытая и очищенная сера составляет значительную часть производства серы. На угольных электростанциях дымовые газы иногда очищаются. Более современные электростанции, использующие синтез-газ, извлекают серу перед сжиганием газа.
Сероводород так же токсичен, как и цианистый водород,[требуется уточнение] и убивает по тому же механизму (ингибирование дыхательного фермента цитохромоксидазы), хотя сероводород менее вероятно вызывает неожиданные отравления от небольших вдыхаемых количеств из-за его неприятного запаха. Сероводород быстро притупляет обоняние, и жертва может дышать все большими количествами, не замечая увеличения, пока тяжелые симптомы не приведут к смерти. Растворенные сульфидные и гидросульфидные соли токсичны по одному и тому же механизму.
См. также[править]
Дальнейшее чтение[править]
Sigel, Astrid; Freisinger, Eva; Sigel, Roland K. O., eds. (2020). Переходные металлы и сера: прочная связь на всю жизнь. Приглашенные Редакторы марта Э Соса Торрес и Питер М. Х. Кронек. Берлин/Бостон: de Gruyter. pp.
Пруф[править]
- Сера
- Химические элементы
- Халькогены
- Реактивные неметаллы
- Многоатомные неметаллы
- Сельскохозяйственная химия
- Препараты против акне
- Биология и фармакология химических элементов
- Диетические минералы
- Промышленные полезные ископаемые
- Неорганические полимеры
- Минералы самородных элементов
- Орторомбические минералы
- Минералы в космической группе 70
- Пиротехническое топливо