I-мотив ДНК
i-мотив ДНК - это тип дезоксирибонуклеиновой кислоты, обнаруженный в ядрах клеток в 2018 году, который находится в ядрах клеток человека. Аббревиатура интеркалированного мотива, четырехнитевой i-мотив не похож на знаковую двойную спираль ДНК. i-мотивы представляют собой четырехцепочечные квадруплексные структуры, образованные богатой цитозином ДНК, аналогичные G-квадруплексным структурам, которые образует ГУАНИНОВАЯ ДНК. C-богатые участки ДНК распространены в участках генной регуляции генома. Недавно, я-мотивы были открыты в человеческих клетках и были показаны, что сыграли роль в воспроизводстве клетки. I-мотивы имеют потенциальные применения в нанотехнологиях и нанотерапии, поскольку размер составляет более 1 нм и менее 100 Нм из-за их уникальной чувствительности к рН и используются в качестве биосенсоров, наномашин и молекулярных переключателей
История[править]
Тип i-мотива был впервые отмечен исследователями в 1990-х годах , но до 2018 года он наблюдался только в пробирке, а не в живых клетках. последнее открытие, объявленное в 2018 году, было возглавлено Институтом медицинских исследований Гарвана и Университетом Нового Южного Уэльса и финансировалось Национальным Советом по здравоохранению и медицинским исследованиям и австралийским исследовательским советом . Соруководителями исследовательской группы были A / Prof Daniel Christ и профессор Марсель Дингер.
Discovery[править]
Доктор Махди Зераати из Института Гарвана говорит, что i-мотив был обнаружен для его появления и исчезновения в клетке и отличительных связей через цитозины, а не парные буквы основы. Исследовательская группа разработала новый точный инструмент для поиска i-мотива-фрагмента молекулы антитела, который может специфически распознавать и присоединять к i-мотивам "с очень высоким сродством".
Структура[править]

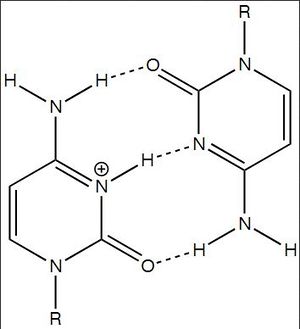
G-квадруплексные структуры ДНК существуют в богатых G областях ДНК . Комплементарная цитозин-богатая Стренга ДНК может также сформировать четырехцепочечную квадруплексную вызванную структуру и-мотивом. Пары оснований цитозина в структуре i-мотива образуют интеркалированную и антипараллельную тетрамерную структуру.эта структура образуется за счет не-Ватсон крик базового спаривания C·C + взаимодействий пар оснований цитозина. C·C + bonding является типом спаривания основания Хогстена и на самом деле имеет более сильные взаимодействия пар оснований и энергию спаривания оснований, чем традиционное спаривание основания Watson Crick G·C: 169,7 кДж / моль для C·C + базовое сопряжение и 96,6 кДж/моль для базового сопряжения G·C. связь C·C + имеет три водородные связи : две между водородом Аминов и двойными связанными кислородами противоположного цитозина, а одна между Азотом и водородом, связанным с N + . Эти пары оснований пересекают две петли ДНК. учитывая гемипротонированную природу нитрогенов в цитозине, участвующих в связывании C·C+, это базовое спаривание традиционно является наиболее стабильным в диапазоне рН=5-6, значительно ниже физиологического рН (7,3). Однако в недавних работах были найдены доказательства существования I-мотивных структур при почти нейтральном рН при комнатной температуре. Wright et al. обнаружено, что количество цитозинов в последовательности определяет, может ли с-богатая последовательность образовывать структуру i-мотива при физиологическом рН, а также отрицательная сверхгеликость и молекулярная скученность. при комнатной температуре нуклеотидные тракты должны быть не менее 5 цитозинов длиной, чтобы свернуться в i-мотивы при почти нейтральном рН; дополнительные цитозины повышают термостабильность. Кроме того, внутримолекулярные пряди i-мотива наиболее стабильны, когда в пряди ДНК содержится не менее 6 последовательных оснований цитозина, в то время как менее 6 последовательных цитозинов в пряди способствуют межмолекулярным C·C + парам. считается, что эта pH-зависимость структуры i-мотива имеет решающее значение для его in vivo активности и функции в клетке, поскольку pH предположительно является механизмом контроля, используемым для образования и разрушения i-мотива.
Биологическая функция[править]
Предполагается, что I-мотивы играют определенную роль в регуляции и экспрессии генов в клетке. большие участки G/C-богатой ДНК существуют вблизи участков начала транскрипции в геноме и присутствуют в широком разнообразии геномов организмов, предполагая, что c-богатые участки имеют биологическую функцию. Кроме того, многие белки и лиганды, имеющие фундаментальное значение для экспрессии генов, распознают c-богатые олигонуклеотиды, такие как Поли-c-связывающий белок ( PCBP ) и гетерогенный ядерный рибонуклеопротеин K ( HNRPK ). До недавнего времени было неясно, существуют ли I-мотивы в ДНК естественным образом из-за их низкой стабильности при физиологическом рН; i-мотивы были обнаружены in vivo в ДНК человека в 2018 году. человеческая теломерная ДНК (hTelo) может формировать вторичную структуру i-мотива in vitro. Zeraati et al. подтверждено наличие i-мотива hTelo в ДНК человека с помощью флуоресцентного маркера под названием iMab. Кроме того, i-мотив hTelo был обнаружен в регуляторных областях генома во время поздней фазы G1 клеточного цикла размножения , что указывает на участие i-мотивов в промоции и регуляции генов. I-мотивы могут также выступать в качестве молекулярных скаффолдов для помощи в связывании фактора транскрипции во время транскрипции гена с помощью вспомогательных промоторов, таких как BCL2, при присоединении к правильной последовательности ДНК. повышенная экспрессия i-мотива не совпадала с повышенной экспрессией G-квадруплекса, которая вместо этого увеличивается в течение фазы S. это указывает на то, что G-квадруплекс и i-мотивы не являются комплементарными структурами, несмотря на их комплементарные последовательности, а являются взаимоисключающими и выполняют противоположные роли в регуляции экспрессии генов.
Приложения[править]
I-мотивы особенно полезны из-за их уникальной чувствительности к изменениям кислотности вблизи физиологического pH. исследование в Университете Бонна использовало складывание I-мотива, чтобы затянуть и ослабить кольцо ДНК. Было синтезировано круговое кольцо ДНК, с определенными участками c-богатой ДНК. При рН 5 эти области сжимаются до образования i-мотивов, затягивая кольцо таким же образом, как закрывая мешок для мусора. При рН 8 области I-мотива снова сжимались в свои линейные формы, ослабляя кольцо. Кольца ДНК, которые могут затягиваться и ослабляться в зависимости от рН, могут быть использованы для построения более сложных структур блокирующей ДНК, таких как катенаны и ротаксаны . эти структуры ДНК могут функционировать как молекулярные переключатели . Другое исследование показало, что одностенные углеродные нанотрубки (Свнтт), обычно используемые для переноса лекарственных веществ в организме, индуцируют образование I-мотива в теломерной ДНК человека. Исследования модифицировали c-богатую человеческую теломерную ДНК путем присоединения редокс-активной метиленовой синей группы к концу 3' и электрода к концу 5'. В конформации I-мотива эта модифицированная нить ДНК вызывает значительное увеличение Фарадеева тока . Этот биосенсор реагирует только на SWNTs, что позволяет исследователям обнаруживать определенный тип углеродной нанотрубки с прямым пределом обнаружения 0,2 ppm.